
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
4.2.3. Роль активации процессов липопероксидации и недостаточности антирадикальной защиты клеток различной морфофункциональной организации в механизмах потенцирования цитопатогенных эффектов токсинов Y.pestis и индукции бактериально-токс
Состояние процессов липопероксидации в крови и тканях внутренних органов при прогрессирующих формах эндотоксикоза, индуцированного введением возрастающих доз липополисахарида чумного микроба
В настоящее время очевидно, что процессам липопероксидации принадлежит существенная роль в регуляции метаболизма мембранных липидов, изменении физико–химических свойств и проницаемости биологических мембран как в условиях нормы, так и в условиях патологии инфекционной и неинфекционной природы [4–6, 11, 14, 15, 18, 26, 41, 45].
Известно, что свободнорадикальное окисление липидов происходит в норме в клетках различных тканей на низком уровне, создавая предпосылки для физиологического обновления биологических мембран.
Продукты липопероксидации регулируют физико-химические свойства биологических мембран, в частности, их вязкость, и, таким образом, оказывают влияние на активность разнообразных мембраносвязанных ферментов.
Индукторами процессов липопероксидации при инфекционной патологии могут выступать не только токсические и ферментные факторы патогенности возбудителей, в том числе Y. pestis, но также гипоксическая, циркуляторная, гемическая, тканевая гипоксия, обусловленная расстройствами микроциркуляции, регионарного кровотока и системной гемодинамики [4, 6, 7, 9, 10, 13].
До настоящего момента вопросы состояния процессов свободнорадикальной дестабилизации биологических мембран и их роли в формировании расстройств коагуляционного потенциала крови, ее реологических свойств при чумной инфекции и интоксикации оставались в значительной степени невыясненными.
В связи с вышеизложенным представлялась очевидной необходимость изучения состояния процессов липопероксидации в крови и тканях в динамике чумного эндотоксикоза, а также выяснения роли указанных метаболических сдвигов в механизмах развития геморрагического синдрома, расстройств регионарного кровотока и микроциркуляции, характерных для тяжелой формы чумной инфекции, интоксикации и развития бактериально-токсического шока.
Для оценки состояния процессов липопероксидации использовали общепринятые интегративные показатели содержания промежуточных продуктов липопероксидации: малонового диальдегида (МДА) и гидроперекисей липидов (ГПЛ) в плазме крови, эритроцитах, а также в гомогенатах сердца, легких, почек, тонкого кишечника, селезенки, печени экспериментальных животных в динамике чумной ЛПС-интоксикации различной степени тяжести.
Тяжесть аутоинтоксикации оценивали по характеру клинических проявлений патологии и уровню молекул средней массы (МСМ) сыворотки крови экспериментальных животных.
В работе использованы варианты моделирования тяжелой формы чумной интоксикации, достигаемые внутрибрюшинным введением беспородным белым мышам фракции ЛПС эндотоксина Y. pestis в дозах, эквивалентных ЛД50 и 2ЛД50, сопровождающиеся развитием эндотоксинового шока.
Исследования проведены в динамике интоксикации: спустя 1,5–2,0; 4,0; 10,0 и 24,0 часа после внутрибрюшинного введения ЛПС экспериментальным животным.
Как оказалось, спустя 1,5–2 часа после внутрибрюшинного введения токсина белым мышам, то есть на фоне одышки, адинамии, было обнаружено значительное повышение уровней МДА, ГПЛ как в плазме крови (р < 0,001) (рис. 1, 3), так и в эритроцитах (р < 0,001) (рис. 2, 4). На этом этапе содержание продуктов липопероксидации в эритроцитах превышало таковые показатели не только группы контроля, но и на аналогичной стадии интоксикации в модификации экспериментов с использованием ЛПС в дозе ЛД25 (р < 0,001). В то же время установлено, что прогрессирующее накопление ГПЛ и МДА в крови сочеталось и с активацией свободнорадикальной дестабилизации биологических мембран клеток различных органов и тканей. Об этом свидетельствовало увеличение содержания МДА и ГПЛ в гомогенатах сердца, легких, печени, почек, тонкого кишечника (р…р < 0,001). Наиболее выраженное увеличение уровня изучаемых продуктов ЛПО было отмечено в гомогенатах печени.
Проведение экспериментальных исследований на стадии тяжелых клинических проявлений интоксикации, сопровождающейся гибелью части животных, – спустя 4,0 часа после введения ЛПС чумного микроба – позволило обнаружить прогрессирующее накопление МДА и ГПЛ как в эритроцитарной массе (р < 0,001) (рис. 2, 4), так и в плазме крови (р < 0,001) (рис. 1, 3), сочетающееся с избыточным накоплением МСМ в сыворотке крови, которое превышало не только показатели контрольной группы животных (р < 0,001), но и показатели аналогичной стадии интоксикации, достигаемой введением ЛПС в дозе ЛД25 (р < 0,001). Одновременно выявлена аналогичная закономерность прогрессирующего накопления МДА и ГПЛ в гомогенатах сердца, печени, кишечника, легких и почек (р…р < 0,001).
В период крайне тяжелых клинических проявлений интоксикации – спустя 10 часов после введения чумного ЛПС в дозе, эквивалентной ЛД50, – отмечалось дальнейшее возрастание уровня МДА в эритроцитах (р < 0,001), ГПЛ – как в плазме крови (р < 0,001), так и в эритроцитах (р < 0,001), а МСМ – в сыворотке крови (р < 0,001). Одновременно отмечено резкое увеличение содержания исследуемых промежуточных продуктов липопероксидации в гомогенатах сердца, легких, кишечника, почек (р…р < 0,001). Вместе с тем в гомогенатах печени дальнейшее накопление МДА по сравнению с результатами предыдущей стадии интоксикации (р < 0,001) сочеталось со стабильно высоким уровнем ГПЛ (р > 0,1).
Спустя 24 часа после введения ЛПС у выживших животных отмечалось избыточное содержание МДА и ГПЛ в плазме крови (р < 0,001) (рис. 4.1, 4.3) и эритроцитах (р < 0,001) (рис. 4.2, 4.4), а МСМ – в сыворотке крови (р < 0,001). Однако следует отметить, что уровень ГПЛ в плазме крови (р < 0,001) и содержание МСМ в сыворотке крови (р < 0,001) снижались по сравнению с соответствующими показателями предыдущей стадии интоксикации, не достигая контроля (р < 0,001].
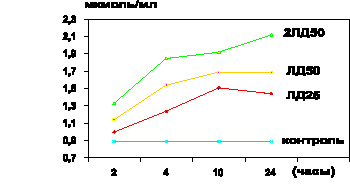
Рис. 4.1. Показатели содержания МДА в плазме крови белых мышей в динамике чумной ЛПС–интоксикации различной степени тяжести
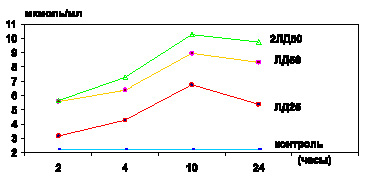
Рис. 4.2. Показатели содержания МДА в эритроцитах белых мышей в динамике чумной ЛПС–интоксикации различной степени тяжести
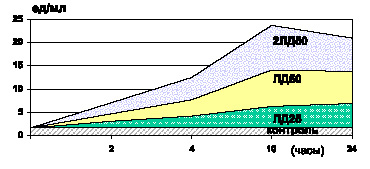
Рис. 4.3. Изменения содержания ГПЛ в плазме крови белых мышей в динамике чумной ЛПС-интоксикации различной степени тяжести
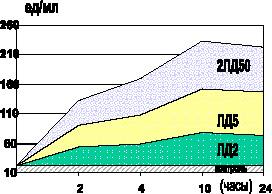
Рис. 4.4. Изменения содержания ГПЛ в эритроцитах белых мышей в динамике чумной ЛПС-интоксикации различной степени тяжести
В то же время обнаружено уменьшение содержания ГПЛ в гомогенатах всех изученных органов, уровня МДА – в тканях легких, сердца, почек, кишечника по сравнению с предыдущей стадией интоксикации (р…р < 0,001). Однако указанные показатели превышали таковые в группе интактных животных (р…р < 0,001). Содержание МДА в гомогенатах печени оставалось высоким, как и на предыдущей стадии интоксикации.
Таким образом, в модификациях экспериментов с использованием ЛПС чумного микроба в дозах, эквивалентных ЛД25 и ЛД50, выявлена дозозависимая активация процессов липопероксидации, проявляющаяся избыточным накоплением промежуточных продуктов (ГПЛ и МДА) и коррелирующая с нарастанием в крови содержания маркеров аутоинтоксикации – МСМ, а также со степенью тяжести клинических проявлений патологии.
В следующей модификации экспериментов интоксикация достигалась внутрибрюшинным введением белым мышам ЛПС Y. pestis в дозе 2ЛД50.
В указанной модификации экспериментов обнаружена закономерность прогрессирующего накопления в крови промежуточных продуктов липопероксидации, аналогичная вышеописанным результатам исследований с использованием ЛПС в дозах ЛД25 и ЛД50. Следует отметить, что в отличие от модификаций экспериментов с использованием меньших доз токсина, уже в ранний период наблюдения, то есть спустя 1,5–2,0 часа после введения ЛПС в дозе 2ЛД50 развивались выраженная активация свободнорадикального окисления липидов и аутоинтоксикация. При этом содержание МДА и ГПЛ в плазме крови и эритроцитарной массе повышалось как по сравнению с таковыми показателями контрольной группы животных (р…р < 0,001) на предшествующих стадиях интоксикации (р…р < 0,001), так и с показателями в соответствующие периоды интоксикаций, индуцируемых введением ЛПС в дозах, эквивалентных ЛД25 и ЛД50 (р…р < 0,001) (рис. 4.1–4.4). Интенсификация липопероксидации в указанном варианте моделирования патологии коррелировала с тяжестью клинических проявлений и степенью выраженности аутоинтоксикации.
В более поздние периоды наблюдения (спустя 4,0 и 10,0 часов после введения ЛПС) утяжеление клинических проявлений интоксикации также сочеталось с прогрессирующим увеличением содержания в крови МСМ (р < 0,001) и исследуемых промежуточных продуктов липопероксидации (р…р < 0,001).
Спустя 24,0 часа после введения ЛПС чумного микроба белым мышам сохранялось высокое содержание МДА (р < 0,001) и ГПЛ (р < 0,001) в плазме крови и эритроцитарной массе, как и на предыдущей стадии интоксикации, превышающее соответствующие показатели аналогичных периодов наблюдения в условиях введения животным меньших доз ЛПС (ЛД25 и ЛД50) (рис. 4.1–4.4).
Таким образом, результаты экспериментальных исследований, проведенных в динамике прогрессирующих форм чумной ЛПС-интоксикации на высокочувствительных к чумному эндотоксину животных – белых мышах – позволили выявить следующие закономерности:
1. Важная роль в реализации молекулярно-клеточных механизмов патогенного действия ЛПС Y.pestis должна быть отведена свободнорадикальной дестабилизации биологических мембран клеток различной морфофункциональной организации, в частности клеток крови и ряда внутренних органов. Об этом свидетельствовала дозозависимая активация процессов липопероксидации, коррелирующая со степенью тяжести аутоинтоксикации и клинических проявлений патологии.
2. В механизмах прогрессирующей активации процессов липопероксидации важная роль может быть отведена формированию тяжелой гипоксии сложного генеза – дыхательной, циркуляторной, гемической и тканевой на высоте клинических проявлений интоксикации. В свою очередь, активация липопероксидации, безусловно, усугубляет развитие тканевой гипоксии, индуцированной токсинами и ферментами патогенности Y. pestis, вызывая дезорганизацию биомембран клеток различной морфофункциональной принадлежности, в том числе паренхимы печени, почек, миокарда, легких, кишечника.
3. Определение содержания в плазме крови и эритроцитах промежуточных продуктов липопероксидации (МДА и ГПЛ), а также МСМ в сыворотке крови может быть использовано для оценки тяжести бактериального эндотоксикоза и эффективности комплексной терапии бактериально-токсического шока, индуцированных Y. pestis.
О роли недостаточности антиоксидантной системы крови и внутренних органов в механизмах свободнорадикальной дестабилизации биосистем при чумной ЛПС-интоксикации
Представленные выше данные свидетельствуют о закономерной дозозависимой активации процессов липопероксидации и накоплении продуктов перекисного окисления липидов в крови, а также в различных органах и тканях в динамике чумной ЛПС–интоксикации у животных различной видовой принадлежности.
Многочисленные клинические и экспериментальные исследования указывают на то, что одним из механизмов свободнорадикальной дестабилизации биологических мембран клеток является недостаточность активности АОС при различных заболеваниях и патологических процессах, в том числе инфекционной природы.
Так, снижение активности супероксиддисмутазы обнаружено при стафилококковом сепсисе, сальмонеллезном эндотоксикозе, на терминальной стадии ботулинической интоксикации. В то же время при аденовирусной инфекции увеличение экспрессии СОД в гепатоцитах защищало их от токсического действия активных форм кислорода.
В ряде работ установлено, что влияние холерных вакцин и токсинов, в частности эндотоксина, сопровождалось уменьшением глутатионпероксидазной и глутатионредуктазной активности крови и гепатоцитов.
При введении чумной и туляремийной живых сухих вакцин нелинейным мышам и морским свинкам обнаружены ингибирование активности супероксиддисмутазы и снижение уровня ?-токоферола, сопровождавшиеся накоплением диеновых конъюгатов и малонового диальдегида у экспериментальных животных. Предварительное введение ацетилхолина с последующей вакцинацией усиливало процессы липопероксидации и в большей степени снижала активность антиоксидантной системы.
Однако систематизированные сведения о состоянии ферментного и неферментного звеньев антиоксидантной системы крови и тканей при чумной инфекции и интоксикации до настоящего момента в литературе практически не существуют.
Как известно, одним из ведущих механизмов защиты биологических мембран клеток от чрезмерной интенсификации липопероксидации в условиях патологии является адекватная активация ферментного и неферментного звеньев антиоксидантной системы, способных как предотвращать образование свободных радикалов и инициацию ими цепных реакций, так и инактивировать уже образовавшиеся активные формы кислорода.
В составе первой группы факторов, препятствующих образованию активных производных кислорода, важное место принадлежит эндогенным биохелаторам, обеспечивающим связывание свободных ионов металлов переменной валентности и стабилизирующим редокс–состояние связанных ионов металлов на должном уровне. В организме превалирует содержание ионов металлов в восстановленном состоянии (в гемоглобине и миоглобине), однако окисленные их формы представлены более разнообразными металл–органическими соединениями, такими как каталаза, геминовые пероксидазы, цитохромы, трансферрин, лактоферрин, ферритины, супероксиддимутазы и другими. Указанные факторы снижают возможность одноэлектронного восстановления молекулярного кислорода и пероксида водорода до свободнорадикальных форм.
Ко второй группе относят ферментные и неферментные антиоксидантные факторы, нейтрализующие активные формы кислорода. Среди ферментных факторов важная роль отводится супероксиддисмутазе (СОД), каталазе и другим. Неферментативные перехватчики свободной валентности действуют либо в липидной фазе биологических мембран – токоферолы, каротиноиды, убихиноны, либо в водной среде – аскорбат, мочевая кислота и другие.
Для решения вопроса о роли недостаточности антиоксидантной защиты клеток различной морфо-функциональной организации были проведены серии экспериментов по изучению активности ферментного и неферментного компонентов антиоксидантной системы крови и тканей внутренних органов у выкочувствительных к действию ЛПС животных – белых мышей в динамике чумной интоксикации. Последняя достигалась внутрибрюшинным введением экспериментальным животным ЛПС Y. pestis в дозах, эквивалентных ЛД50 и 2ЛД50.
Для оценки активности антиоксидантной системы крови и тканей использовали такие показатели, как содержание витамина Е в сыворотке крови, уровень активности СОД в цельной крови, каталазы в эритроцитах, а также интегративные показатели состояния антиоксидантной системы и стабильности биологических мембран – перекисную устойчивость эритроцитов и содержание общих сульфгидрильных групп в сыворотке крови.
Эксперименты были проведены на беспородных белых мышах обоего пола массой 18–20 г с использованием чумного ЛПС в дозе, эквивалентной ЛД50, спустя 1,5–2,0; 4,0; 10,0 и 24,0 часа после внутрибрюшинного введения токсина экспериментальным животным.
Как оказалось, уже на ранней стадии интоксикации, спустя 1,5–2,0 часа после введения ЛПС Y. pestis в дозе, эквивалентной ЛД50, был отмечен дозозависимый эффект подавления активности антиоксидантной системы крови белых мышей. О степени адекватности антиоксидантной защиты биологических мембран состоянию активности процессов липопероксидации при чумном эндотоксикозе судили по интегративному показателю стабильности биологических мембран – перекисной устойчивости эритроцитов, содержанию витамина Е, а также уровню общих сульфгидрильных групп в сыворотке крови. Определение содержания сульфгидрильных групп в сыворотке крови представлялось целесообразным в силу ряда причин. Так, с одной стороны, SH-группы являются важным компонентом неферментного звена антиоксидантной системы. С другой стороны, суммарный уровень сульфгидрильных групп сыворотки крови выступает в роли интегративного параметра состояния антиоксидантной защиты белковых фракций, пептидов, аминокислот, ферментов и других компонентов плазмы крови, а также стромальных и ферментативных клеточных белков, содержащих тиоловые группы и, соответственно, степени проницаемости биологических мембран клеток на фоне активации процессов липопероксидации. На ранней стадии интоксикации содержание витамина Е (р < 0,001) (рис. 4.7), общих сульфгидрильных групп в сыворотке крови (р < 0,001), перекисная устойчивость эритроцитов уменьшались (р < 0,001) (рис. 4.5).
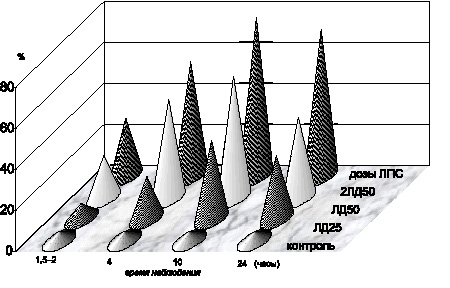
Рис. 4.5. Изменения перекисной резистентности эритроцитов белых мышей в динамике чумной ЛПС-интоксикации
В то же время в данной модификации экспериментов активность СОД цельной крови снижалась (р < 0,001) (рис. 4.5), однако происходило одновременное повышение активности каталазы эритроцитарной массы (р < 0,01) (рис. 4.6). Как известно, функции изученных ферментов антиоксидантной системы тесно взаимосвязаны. Так, СОД катализирует инактивацию О2– с образованием в результате реакции перекиси водорода. Среди механизмов удаления образующейся H2O2 и предотвращения окислительной деструкции в клетках наиболее значимым является каталитическое разрушение перекиси водорода с участием пероксисомальной каталазы. Эти факты определили целесообразность одновременного изучения нами активности СОД и каталазы крови экспериментальных животных во всех модификациях экспериментов.
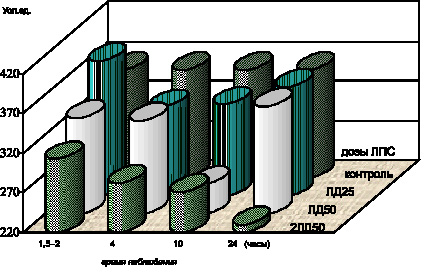
Рис. 4.6. Изменения активности супероксиддисмутазы крови белых мышей в динамике чумной ЛПС-интоксикации
В аналогичных исследованиях на белых мышах с использованием ЛПС Y.pestis в дозе, эквивалентной ЛД50, показано, что уже в ранний период интоксикации – спустя 1,5–2,0 часа после введения токсина – возникает угнетение СОД, каталазы, а также уменьшение содержания витамина Е в гомогенатах почек, печени, тонкого кишечника (р…р < 0,001). В гомогенатах легких снижение содержания витамина Е (р < 0,001) и активности каталазы (р < 0,001) происходило на фоне неизменной активности СОД. В гомогенатах сердца все изучаемые показатели не изменялись.
Таким образом, и в этих модификациях экспериментов показана недостаточность антиоксидантной системы крови и тканей внутренних органов, причем в первую очередь в крови истощалась активность СОД, наряду со снижением уровня витамина Е и общих сульфгидрильных групп.
В то же время недостаточность тканевых ферментных и неферментных факторов антирадикальной защиты клеток обнаруживалась прежде всего в гомогенатах почек, печени и кишечника – органах, обеспечивающих инактивацию и элиминацию различных токсических соединений экзогенной и эндогенной природы.
Использование этой же модели ЛПС–интоксикации позволило обнаружить, что по мере утяжеления клинических проявлений интоксикации спустя 4,0 и 10,0 часов после введения ЛПС белым мышам отмечалось дальнейшее снижение содержания витамина Е (р < 0,001) (рис. 4.7), общих сульфгидрильных групп в сыворотке крови (р < 0,001), активности СОД цельной крови (р < 0,001) и перекисной резистентности эритроцитов (р < 0,001). Активность каталазы эритроцитов уменьшалась как по сравнению с показателями контрольной группы животных (р < 0,001), так и по сравнению с результатами предыдущих стадий интоксикации в модификациях экспериментов с использованием доз ЛПС чумного микроба, эквивалентных ЛД50 (р < 0,001) (рис. 4.8).
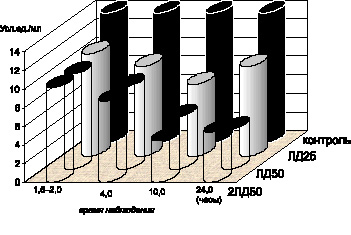
Рис. 4.7. Показатели содержания витамина Е в сыворотке крови белых мышей в динамике чумной ЛПС–интоксикации
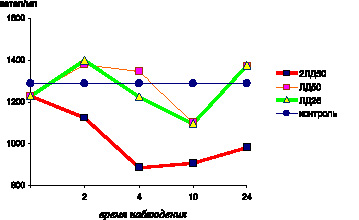
Рис. 4.8. Активность каталазы в эритроцитах белых в сыворотке крови белых мышей в динамике чумной ЛПС-интоксикации
В то же время спустя 4,0 и 10,0 часов после введения ЛПС в дозе ЛД50 белым мышам обнаружено прогрессирующее снижение активности СОД (р…р < 0,001), каталазы (р…р < 0,001), содержания витамина Е (р…р < 0,001) в гомогенатах почек, печени, тонкого кишечника, легких, сердца.
Спустя 24,0 часа после введения ЛПС в группе выживших животных содержание витамина Е (р < 0,001) (рис. 4.7) и SH-групп в сыворотке крови (р < 0,001) оставалось на прежнем низком уровне. Активность каталазы эритроцитов (р < 0,001) и СОД цельной крови (р < 0,001) (рис. 4.6) увеличивалась по сравнению с результатами предыдущей стадии интоксикации при использовании дозы ЛД50, не достигая уровня показателей контрольной группы животных. На этом фоне перекисная устойчивость эритроцитов продолжала снижаться (р < 0,001) (рис. 4.5). Повышение активности каталазы (р < 0,001) и СОД (р < 0,001) отмечалось в гомогенатах легких по сравнению с показателями предыдущих стадий интоксикации, однако нормализации этих показателей не происходило. Активность каталазы печени (р < 0,001), кишечника (р < 0,001), СОД (р < 0,001) и каталазы почек (р < 0,001) сохранялась на прежнем низком уровне. Одновременно отмечалось дальнейшее падение уровня активности СОД в гомогенатах печени (р < 0,001), кишечника (р < 0,001), СОД (р < 0,001) и каталазы (р < 0,001) – в гомогенатах сердца по сравнению с результатами предыдущей стадии интоксикации – спустя 10,0 часов после введении ЛПС в дозе ЛД50. Содержание витамина Е в гомогенатах всех исследованных органов прогрессирующе уменьшалось (р < 0,001).
Таким образом, использование ЛПС чумного микроба в дозе, эквивалентной ЛД50, обусловливало развитие выраженной недостаточности ферментного звена антиоксидантной системы крови и внутренних органов, обнаруживающей параллелизм и, следовательно, патогенетическую взаимосвязь с тяжестью клинических проявлений ЛПС–интоксикации. Указанное положение может быть аргументировано и результатами, свидетельствующими о значительном дефиците витамина Е в крови и тканях, а также тиоловых соединений в крови, угнетении активности СОД, каталазы в крови и тканях различных органов в указанной модификации экспериментов.
При использовании абсолютно летальной дозы ЛПС (2ЛД50) уже спустя 1,5–2,0 часа после введения токсина обнаружено значительное снижение всех показателей и ферментного и неферментного звеньев антиоксидантной системы: содержания витамина Е (р < 0,001), сульфгидрильных групп в сыворотке крови (р < 0,001), активности каталазы в эритроцитарной массе (р < 0,001), СОД – в цельной крови (р < 0,001), а также интегративного показателя – перекисной резистентности эритроцитов (р < 0,001) как по сравнению с контролем, так и по сравнению с аналогичной стадией интоксикации в модификации экспериментов с использованием меньших доз ЛПС – ЛД25 и ЛД50 (р…р < 0,001).
Спустя 4,0 часа после введения ЛПС значительное утяжеление клинических проявлений интоксикации сопровождалось снижением всех изучаемых показателей активности антиоксидантной системы по сравнению с аналогичной стадией экспериментов при использовании меньших доз ЛПС (ЛД25 и 2ЛД50]. Отмечалось прогрессирующее снижение содержания витамина Е в сыворотке крови (р < 0,001), активности СОД цельной крови (р < 0,001) (рис. 4.8), каталазы эритроцитов (р < 0,02), перекисной резистентности эритроцитов (р < 0,001) по сравнению с предыдущей стадией интоксикации, достигаемой введением ЛПС в дозе, эквивалентной 2ЛД50.
На этапе крайне тяжелых клинических проявлений интоксикации, спустя 10,0 часов после введения токсина, сохранялись низкое содержание витамина Е (р < 0,001) и активность каталазы эритроцитов (р < 0,001). Содержание общих SH-групп (р < 0,001), перекисной устойчивости эритроцитов (р < 0,001) (рис. 4.7), активность СОД крови (р < 0,001) уменьшались по сравнению с показателями предыдущей стадии интоксикации (ЛПС в дозе 2ЛД50).
Спустя 24,0 часа после введения ЛПС в дозе 2ЛД50 в группе выживших животных сохранялся низкий уровень содержания витамина Е (р < 0,001), общих сульфгидрильных групп сыворотки крови (р < 0,001), показателя перекисной резистентности эритроцитов (р < 0,001) Активность каталазы эритроцитов и СОД цельной крови продолжала снижаться (р < 0,001).
Следует отметить, что все изучаемые показатели состояния антиоксидантной системы в периоды интоксикации спустя 10,0 и 24,0 часа после введения токсина в изученной модификации экспериментов были значительно снижены по сравнению с результатами аналогичных периодов патологии при введении ЛПС в меньших дозах (ЛД25 и ЛД50).
Таким образом, результаты проведенных экспериментов указывают на развитие дозозависимого эффекта угнетения активности ферментного звена антиоксидантной системы и снижения содержания витамина Е и сульфгидрильных групп крови в динамике прогрессирующих форм чумной ЛПС-интоксикации.
Результаты проведенных исследований позволяют заключить:
1. Ведущим молекулярно-клеточным механизмом дезорганизации биосистем при чумной ЛПС-интоксикации у высокочувствительных к действию эндотоксина животных – белых мышей – является недостаточность антирадикальной защиты клеток различной морфо-функциональной организации, коррелирующая с тяжестью клинических проявлений интоксикации.
2. Прогрессирующая недостаточность содержания в крови и гомогенатах внутренних органов витамина Е, подавление активности СОД и каталазы являются одним из патогенетических факторов чрезмерного накопления активных форм кислорода, в частности супероксидного анион-радикала, синглетного кислорода, перекиси водорода и других радикалов, что приводит к развитию цепных реакций липопероксидации, модификации структурных и ферментных белков в биологических мембранах, белковых и липидных компонентов плазмы крови.
3. Комплексная терапия бактериально-токсического шока при инфекциях, вызванных грамотрицательной микрофлорой, в том числе Y. pestis, должна включать антиоксидантные, антигипоксантные, мембранопротекторные препараты.
4. Мониторинг показателей содержания витамина Е, общих сульфгидрильных групп в сыворотке крови, активности СОД, каталазы крови может быть использован в целях оценки эффективности комплексной терапии, прогнозирования тяжести течения и исхода чумной инфекции и интоксикации.
Взаимомодулирующие эффекты липополисахарида и «мышиного» токсина Y. pestis на состояние процессов липопероксидации и антиоксидантной системы клеток различной морфо-функциональной организации при прогрессирующих формах чумной интоксикации
Как известно, в организме хозяина в условиях лизиса бактериальных клеток ЛПС образует комплексы с «мышиным» токсином, обладающие более высокой избирательной цитопатогенностью в отношении мышей и крыс по сравнению с эффектами нативных ЛПС и «мышиного» токсина [35–38, 48,49].
В связи с этим в последующих сериях экспериментов представлялось целесообразным изучить молекулярно–клеточные механизмы взаимопотенцирующих эффектов ЛПС и «мышиного» токсина Y. pestis, в частности, установить, не связаны ли указанные механизмы с интенсификацией свободнорадикальной дестабилизации биологических мембран, недостаточности антирадикальной защиты клеток различной морфо-функциональной организации.
В этих целях моделирование чумной интоксикации достигалось внутрибрюшинным сочетанным введением ЛПС и «мышиного» токсина белым мышам в дозах, эквивалентных ЛД50.
Прежде всего изучено состояние процессов липопероксидации и активности антиоксидантной системы крови и тканей внутренних органов при воздействии ЛПС и «мышиного» токсина Y. pestis в экспериментах на высокочувствительных животных – белых мышах – в динамике интоксикации: спустя 1,5–2,0; 4,0 и 10,0 часов после сочетанного введения токсинов в дозах, эквивалентных ЛД50. Указанная модель интоксикации характеризовалась развитием тяжелых клинических проявлений патологии уже в ранний период наблюдения (спустя 1,5–2,0 часа) с последующей массовой гибелью животных спустя 4,0 и 10,0 часов после введения токсинов. В связи с этим не представлялось возможности проводить исследования спустя 24,0 часа, как это осуществлялось в других модификациях экспериментов.
В указанной модели экспериментов выявлена чрезвычайно интенсивная активация процессов липопероксидации уже спустя 1,5–2,0 часа после сочетанного введения ЛПС и «мышиного» токсина Y. pestis белым мышам. Об этом свидетельствовало значительное увеличение содержания продуктов липопероксидации – МДА и ГПЛ в плазме крови (р…р < 0,001) и эритроцитах (р…р < 0,001), а также МСМ в сыворотке крови (р < 0,001) – маркеров аутоинтоксикации как по сравнению с контролем, так и по сравнению с показателями аналогичной стадии в модификации экспериментов с использованием лишь ЛПС в дозе, эквивалентной ЛД50 (р…р < 0,001).
Одновременно отмечалось значительное снижение активности СОД цельной крови (р < 0,001) и каталазы эритроцитов (р < 0,001), содержания витамина Е (р < 0,001) и сульфгидрильных групп в сыворотке крови (р < 0,001) не только по сравнению с контролем, но и по сравнению с ранней стадией интоксикации, достигаемой введением только ЛПС чумного микроба (р…р < 0,001).
В параллельно проведенных исследованиях внутренних органов обнаружены накопление избытка ГПЛ (р…р < 0,001) и МДА (р…р < 0,001), недостаточная активность каталазы (р…р < 0,001), СОД (р…р < 0,001), низкое содержание витамина Е (р…р < 0,001) в гомогенатах легких, сердца, почек, печени, тонкого кишечника. Активация процессов липопероксидации и недостаточность антиоксидантной системы в тканях внутренних органов в этой модификации экспериментов (сочетанное введение ЛПС и «мышиного» токсина в дозе ЛД50) были значительно более выражены, чем в аналогичный период интоксикации в экспериментах на белых мышах с использованием только ЛПС в дозе, эквивалентной ЛД50.
В последующих сериях экспериментов – спустя 4,0 и 10,0 часов после сочетанного введения токсинов белым мышам – обнаружено дальнейшее значительное увеличение содержания продуктов свободнорадикального окисления липидов в плазме крови, эритроцитах и гомогенатах всех исследуемых органов (р…р < 0,001), а также МСМ в сыворотке крови (р…р < 0,001) как по сравнению с показателями предшествующей стадии интоксикации, так и по сравнению с показателями аналогичных стадий интоксикации, достигаемой введением ЛПС в дозе ЛД50. В то же время происходило прогрессирующее снижение активности антиоксидантной системы: угнетение СОД цельной крови (р…р < 0,001), каталазы эритроцитарной массы (р…р < 0,001), снижение содержания витамина Е (р…р < 0,001) и общих SH-групп в сыворотке крови (р…р < 0,001), сочетающиеся с падением перекисной устойчивости эритроцитов (р…р < 0,001).
Угнетение активности СОД, каталазы, снижение содержания витамина Е, прогрессирующие по мере утяжеления клинических проявлений патологии, наблюдались и в гомогенатах легких, сердца, почек, печени и тонкого кишечника (р…р < 0,001). Полученные результаты экспериментов продемонстрировали значительно более выраженные изменения показателей состояния свободно–радикального окисления липидов и активности антирадикальной защиты в модификации чумной интоксикации, достигаемой сочетанным введением белым мышам ЛПС и «мышиного» токсина Y. pestis в дозе, эквивалентной ЛД50, по сравнению с результатами использования только ЛПС Y. pestis в аналогичной дозе.
Таким образом, использование модели интоксикации, достигаемой сочетанным введением ЛПС и «мышиного» токсина чумного микроба, позволило выявить важную закономерность. Последняя заключалась в том, что усиление летального и цитопатогенного эффектов при комбинированном воздействии токсинов на высокочувствительных животных – белых мышей – обусловлено включением неспецифических механизмов дестабилизации биологических мембран в процессе интенсификации липопероксидации.
Резюмируя приведенные выше данные в целом, следует заключить, что взаимопотенцирование летального и цитопатогенного эффектов ЛПС и «мышиного» токсина Y.pestis обусловливается за счет формирования в динамике интоксикации стереотипных закономерностей нарушений метаболического статуса, обнаруженных на животных различной видовой принадлежности. При этом эфферентным звеном дестабилизации биологических мембран в динамике бактериальных интоксикаций, достигаемых использованием ЛПС или «мышиного» токсина Y. pestis или их комбинированным воздействием, является дозозависимая активация процессов липопероксидации на фоне недостаточности антирадикальной защиты клеток крови и тканей внутренних органов. Максимально выраженные эффекты свободнорадикальной дестабилизации биомембран обнаружены при чумной интоксикации, достигаемой комбинированным воздействием ЛПС и «мышиного» токсина Y. pestis.
Обобщая результаты исследований, проведенных с использованием различных вариантов моделирования чумной интоксикации, можно сделать заключение о целесообразности использования антиоксидантов, антигипоксантов и мембранопротекторов в комбинированной терапии чумной инфекции и интоксикации в целях депотенцирования патогенных эффектов токсинов Y. pestis. В то же время становятся очевидными возможности применения новых принципов диагностики, оценки эффективности комплексной терапии чумной инфекции и интоксикации, прогнозирования течения заболевания в соответствии с мониторингом интегративных показателей содержания в крови промежуточных продуктов липопероксидации и состояния антирадикальной защиты клеток крови в динамике патологии.
Указатель основной литературы
-
Анисимов А.П.//Молекул.генетика, микробиол. и вирусол.–2002.–№3.–С. 3–23.
-
Арутюнов Ю.И. // Эпидемиол. и инфекц. болезни.– 2004. – №1.– С. 12–17.
-
Арутюнов Ю.И. и соавт. //Проблемы биологической и экологической безопасности: матер. междунар. конф. – Оболенск, 2000. – С. 12.
-
Афанасьева Г.А., Чеснокова Н.П.//Фундамент. исследования.–2005.–№2.–С. 115.
-
Афанасьева Г.А., Чеснокова Н.П. // Ж.Паллиативная медицина и реабилитация. – 2006. – № 2. – С.6.
-
Афанасьева Г.А., Чеснокова Н.П.// Ж. Успехи современного естествознания. – 2006. – №12. – С.41.
-
Афанасьева Г.А., Чеснокова Н.П.// Активные формы кислорода, оксид азота, антиоксиданты и здоровье человека: Материалы 5-й национальной науч.–практич. конф. – Смоленск, 2007. – Изд–во СГУ «Смоленский ЦНТИ»,2007. – С. 401–402.
-
Афанасьева Г.А., Чеснокова Н.П., Дальвадянц С.М. //Международные медико–санитарные правила и реализация глобальной стратегии борьбы с инфекционными болезнями в государствах – участниках СНГ: Материалы YIII Межгосударственной научн.–практич.конф. государств – участников СНГ, Саратов, 2007. – С. 158–160.
-
Афанасьева Г.А., Чеснокова Н.П., Будник И.А./ Известия высших учебных заведений. Поволжский регион. Медицинские науки. – 2008. – №1. – С. 3–8.
-
Афанасьева Г.А., Чеснокова Н.П., Герасимова М.В. // Актуальные проблемы современной науки: Материалы 4-го Международного форума – Естественные науки. Часть 24. Медицинские науки (Самара,17–19 ноября 2008 г.]. – Самара, 2008. – С. 13–16.
-
Афанасьева Г.А.// В кн.: Докторантские чтения. Выпуск 1. – Саратов, 2008. – С. 212–214.
-
Афанасьева Г.А., Чеснокова Н.П.// Фундаментальные исследования. – 2008. – № 3. – С. 49–52.
-
Афанасьева Г.А., Чеснокова Н.П., Кудин Г.Б.// Медицина и качество жизни. – 2008. – №3. – С. 9.
-
Афанасьева Г.А., Чеснокова Н.П. // Морфология. – 2008. – №4. – С. 101.
-
Афанасьева Г.А.// Молодежь и медицинская наука ХХ1 века: Матер. науч.–практ. конф. с международн. участием. – Изд–во Южно–Казахстанской мед. академии. – Шымкент, 2008. –С. 266–269.
-
Афанасьева Г.А., Чеснокова Н.П.// Вестник Саратовского госагроуниверситета им. Н.И. Вавилова. – 2008. – №2. – С. 18–19.
-
Афанасьева Г.А., Чеснокова Н.П., Захарова Н.Б.// Аллергология и иммунология. – 2008. – Т.9. – №3. – С. 273–274.
-
Барсуков В.Ю. Закономерности метаболических расстройств при раке прямой кишки и патогенетическое обоснование принципов их медикаментозной коррекции: Автореф. дис. … канд.мед.наук. – Саратов, 2000.
-
Белов Л.Г. // Матер. Науч.–практ.конф., посвящ.100–летию образования противочумной службы в России.– Саратов, 1997.– Т.1.– С. 183–184.
-
Белов Л.Г. // Там же – С. 184–185.
-
Брилль Г.Е., Чеснокова Н.П., Полутова Н.В. //Актуальные проблемы патофизиологии: Межвуз. конф.молодых ученых.– СПб., 2001.– С. 206.
-
Булгакова Е.Г., Кутырев В.В. // Матер. VIII Всерос. съезда эпидемиологов, микробиологов и паразитологов: Сб. статей. В 4 томах. – М.: ООО «Росинэкс», 2002. – Т.1. – С. 142.
-
Варивода Т.Ю., Каграманов В.С. // Проблемы биологической и экологической безопасности: Матер. междунар. конф.– Оболенск, 2000. – С. 12–13.
-
Васильева Г.И., Беспалова И.А., Мишанькин М.Б. и соавт. //Фундаментальные исследования. – 2005. – №2– С. 25.
-
Васильева Г.И., Козловский В.Н., Мишанькин Б.Н. и соавт. //Иммунология.– 2003. – №1 .– С.6.
-
Глухова Т.Н. Патогенез расстройств системной гемодинамики, регионарного кровотока и микроциркуляции при гестозе. Патогенетическое обоснование принципов их медикаментозной коррекции: Автореф.дис…. докт. мед. наук.– Саратов, 2004.
-
Дальвадянц С.М., Земцова И.Н., Белобородов Р.А. и соавт. //Профилактика особоопасных инф.– Саратов,1980.– С. 31–33.
-
Дмитровский А.М. // Профилактика и меры борьбы с чумой: Матер. межгосударственной науч. конф.– Алма–Ата, 1994.– С. 17–18.
-
Евлахова С.П., Мишанькин Б.Н. // Биотехнология. – 1994. – №8. – С. 21–24.
-
Наумов А.В., Ледванов М.Ю, Дроздов И.Г. Иммунология чумы.– Саратов, 1992.
-
Каграманов В.С., Асеева Л.Е., Вагнер В.П. //Журнал микробиологии, эпидемиологии и иммунобиологии. –2001. – №3. – С. 8–11.
-
Косилко С.А., Инокентьева Т.И., Михайлов Е.П. // Chin.J.Control Endemic Disease.– 1999.– Vol.14.– P. 203–206.
-
Курникова В.В., Чеснокова Н.П., Салов И.А. // Матер.междунар. конгресса «Практикующий врач».– Дагомыс, 2002.– С. 336.
-
Кутырев В.В., Смирнова Н.И. //Молекулярная генетика, микробиол. и вирусология.– 2003. – №1.– С.6–14.
-
Мишанькин Б.Н., Москвитина Э.А., Ломов Ю.М. и соавт. //ЗНиСО.– 1995. – №8. – С. 29.
-
Мишанькин М.Б., Васильева Г.И., Козловский В.Н. и соавт. // Диагностика, лечение и профилактика опасных инфекционных заболеваний. Биотехнология. Ветеринария.– Киров, 1998.– С. 171–172.
-
Мишанькин М.Б. Структурно-функциональная характеристика «мышиного» токсина чумного микроба: Автореф.дис... канд. мед. наук.– Ростов–н/Д, 1997. – 25 с.
-
Мишанькин М.Б., Мишанькин Б.Н. // Актуальные проблемы профилактики особо опасных и природно–очаговых инфекционных болезней – Иркутск, 1994.– С. 112–113.
-
Наумов А.В., Кузьмиченко И.А., Тараненко Т.М. // Мед. паразитол. и паразитар.болезни.– 1995.– №4.– С. 17–22.
-
Полутова Н.В. Изменение лимфомикроциркуляции и адрено-реактивности лимфатических микрососудов при действии чумного аутолизата: дис… канд. мед. наук. – Саратов, 2001.
-
Понукалина Е.В. Состояние коагуляционного гемостаза при чумной интоксикации: Дис. канд. мед. наук. – Саратов, 1990.
-
Понукалина Е.В., Афанасьева Г.А., Жевак Т.Н. и соавт. // Тез. докл.2–го Рос.конгр.по патофизиологии с междунар.участием «Патофизиология органов и систем. Типовые патологические процессы (экспериментальные и клинические аспекты)».– М., 2000.– С. 202.
-
Понукалина Е.В., Афанасьева Г.А., Киричук В.Ф. и соавт. // Патол.физиология и эксперим. терапия.– 2001. – №3. – С. 7–8.
-
Понукалина Е.В., Маслякова Г.Н., Ковалев В.И. и соавт. Патогенез геморрагического синдрома при чумной интоксикации: Учебно–методические рекомендации.– Саратов,1990.– 144с.
-
Понукалина Е.В., Чеснокова Н.П., Афанасьева Г.А. и соавт. // Матер. V междунар. конф. «Биоантиоксидант». – М., 1998.– С. 187.
-
Поярков А.Ю., Сухоруков В.П., Романов В.Е. // Вестн. интенсивной терапии. – 2004. – №4.– С. 38–44.
-
Романов В.Е., Васильев Н.Т., Шабалин Б.А. // Антибиотики и химиотерапия. – 2001. – Т.46, №4.– С. 16–18.
-
Соколова Е.П. Механизмы активации токсических субстанций чумного микроба: Дис. … канд. биол. наук. – Саратов, 2002.
-
Соколова Е.П., Марченков В.И., Демидова Г.В. // Биотехнология.– 2001. – №4.– С.58–63.
-
Тараненко Т.М., Ермакова Г.В., Андреева И.П. и соавт. // 2–я Всесоюз. конф. «Бактериальные токсины».– Юрмала,1989.– С. 128.
-
Тараненко Т.М., Ермакова Г.В., Андреева И.П. // Микробиол., биохим. и специфич. профилакт. карантинных инф.– Саратов,1990.– С. 49–51.
-
Тернова В.И., Козырева Л.А., Голотина Н.Б. и соавт. // Там же.– С. 59–66.
-
Ульянова О.В. Влияние живых чумной и туляремийной вакцин на показатели пуринового обмена и перекисного окисления липидов у экспериментальных животных: Дис. … канд. мед .наук. – Саратов, 1999.
-
Федорова В.А., Девдариани З.Л. // Молекул. генетика, микробиол. и вирусология.– 1998. – №3.– С. 22–26.
-
Черепанов П.А., Каримова Г.А., Михайлова Т.Г. и соавт. // Новые технологии и биосистемы. Достижения и перспективы:– Матер. 14–й науч.–практ. конф. Оболенск, 1991.– С. 24–26.
-
Черкасова Т.Д. //Журн. микробиол., эпидемиол., иммунобиол.– 1991. – №5.– С. 9–11.
-
Черкасова Т.Д., Венгров П.Р., Мелихов В.И. и соавт. //Бюл. эксперим. биологии и медицины. – 1988.– Т.105, №3.– С. 313–315.
-
Черкасова Т.Д., Шепелева Г.К., Венгров П.Р. и соавт. // Журн. микробиол., эпидемиол., иммунобиол.– 1989. – №1.– С. 3–6.
-
Черкасова Г.Д., Юркив В.А., Покровский В.И. // Бюл. эксперим. биологии и медицины.– 1994. – №2.– С. 153–155.
-
Чеснокова Н.П., Афанасьева Г.А. // Тез. докл. межвуз. конф., посвященной юбилею кафедры клинической фармакологии СГМУ.– Саратов, 1998. – С. 167.
-
Чеснокова Н.П., Афанасьева Г.А. // Сб. науч. работ 5–го конгресса.– М., 2003.– С. 152.
-
Чеснокова Н.П., Моррисон В.В., Понукалина Е.В. и соавт. // Реаниматология, ее роль в современной медицине: Матер. конф.– М., 2004.– С. 251–255.
-
Чеснокова Н.П., Понукалина Е.В., Афанасьева Г.А. и соавт. // Матер. 5-й междунар. конф. «Биоантиоксидант».– М., 1998.– С. 187.
-
Чеснокова Н.П., Понукалина Е.В., Афанасьева Г.А. и соавт. // Рос. морфол. ведомости.– №3–4. – 2000.– С. 177–182.
-
Чеснокова Н.П., Понукалина Е.В., Афанасьева Г.А. и соавт. // Актуальные проблемы патанатомии и судебной медицины: Сб. науч. работ.– Саратов, 2001.– С. 84–85.
-
Чеснокова Н.П., Понукалина Е.В., Дальвадянц С.М. и соавт. // Успехи совр. естествознания.– 2003. – №3.– С. 53.
-
Aussel L., Therisod H., Karibian D et al. // FEBS Lett.– 2000.– Vol.465. – №1.–P. 87–92.
-
Chesnokova N., Afanasieva G., Ponucalina E. // Pathophysiology. The official Journal of international Soceity fo, III International Congress of Pathophysiology, Lautu, Finland, 28 Yune–3 Yuli, 1998.– P.17.
-
Kirichuk V.F., Chesnokova N.P., Afanasieva G.A. et al. // Proc. Internation.Society for Pathophysiology I.– M., 1991.– P.231.
-
Lippi D., Conti A. // J. Infect. – 2002. – Vol.44. – №4. – p.226–228.
-
Minka S., Bruneteau M. //Can.J.Microbiol.– 1998.– Vol. 44. –№5.– P.477–481.
-
Montie T.C., Montie D.B. //Biochemistry.– 1971.– Vol.70.– P.2094–2100.
-
Whitby M., Ruff T.A., Street A.C., Fenner F.J.//– Med. J. Austral. – 2002. Vol.176. –№12. – P.605–608.
