
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ПАРАТГОРМОН-РОДСТВЕННЫЙ ПРОТЕИН
Курзанов А. Н., Ледванов М. Ю., Быков И. М., Медведев В. Л., Стрыгина Е. А., Бизенкова М. Н., Заболотских Н. В., Ковалев Д. В., Стукова Н. Ю.,
1.1.1. Паратгормон-родственный белок и продукты его посттрансляционного процессинга
В течение трех последних десятилетий структурно-родственные биологически активные молекулы семейства паратгормона стали предметом растущего интереса, и среди них особое внимание исследователей привлекает ПТГрП [Schĺüter K.D. (1999)].
Молярная масса ПТГрП – 20194 Да.
Пространственная модель NH2-терминального домена ПТГрП (1-34) человека (рис. 1).

Рис. 1. Структура человеческого паратгормон-родственного белка (1-34), в почти физиологическом растворе (RCSB BPD – 1BZG)
Представлена структура биологически активного NH2-терминального домена ПТГрП (1-34) человека, определенная с помощью двухмерной протонной магнитно-резонансной спектроскопии. Улучшенная стратегия расчета структуры показала наличие двух спиралей His-5-Leu-8 и Gln-16-Leu-27, связанных гибким линкером. (Weidler M., Marx U.C., Seidel G., Schafer W., Hoffmann E., Esswein A., Rosch. The structure of human parathyroid hormone-related protein(1-34) in near-physiological solution. FEBS Lett. 1999 Feb 12;444(2-3):239-44).
N-концевые домены ПТГ (1-34) и ПТГрП (1-34) в значительной степени сохраняются в эволюции, имеют большую степень структурной гомологии, причем восемь из первых 13 аминокислот идентичны и имеют высокую степень прогнозируемой вторичной структуры в течение следующих 21 аминокислоты (Barden J.A., Cuthbertson R.M., 1993; Ray F.R., et al., 1993), что имеет важное значение для связывания рецептора и трансдукции гормонального сигнала (Gardella T.J., Juppner H., 2001; Gensure R.C., et al., 2005).
Альтернативное сплайсинг генерирует несколько разных видов мРНК, которые кодируют три отдельные изоформы белка. В различных изоформах молекула ПТГрП содержит 139, 141 либо 173 аминокислоты (Thiede M.A., et al., 1988; Mangin M., et al., 1988). Исходные продукты трансляции, образующие изоформы ПТГрП, различаются, в основном, за счет С-концевого фрагмента. Первые 111 аминокислот ПTГрП являются чрезвычайно консервативной частью структуры молекулы у многих видов. На аминокислотном уровне ПТГрП куриных имеет 91 % сходство с ПТГрП человека, ПTГрП рыбы фугу имеет 53 % сходство с человеческим ПТГрП (Danks J.A., et al., 2003).. ПТГрП млекопитающих имеют области, которые являются потенциальными сайтами посттрансляционной обработки ферментативным расщеплением, амидированием и гликозилированием (Orloff J.J., et al., 1994), генерируя несколько доменов с различными физиологическими функциями. Распределение эндопептидазы (PTP) (прогормон-тиол-протеаза), прогормонных конвертаз 1 и 2 (PC1 и PC2) может различаться в разных тканях (Deftos L.J. et al., 2001).
Из этих белковых структур в результате посттрансляционного процессинга формируются зрелые секреторные формы биологически активных пептидов, каждый из которых имеет свою собственную функциональную роль в организме участвуя в инициации и регуляции различных физиологических, патофизиологических и патобиохимических эффектов (Orloff J.J. et al., 1994; Strewler G.J. et al., 1987; Zheng M.H. et al., 1994; Luparello C., 2010). К зрелым секреторным формам пептидов относят: N-концевой домен (1-34 или 1-36), срединный фрагмент (midregion) (38-94 или 67-86) и С-концевой домен (osteostatin) (107-139 или 102-141) (Strewler G.J., 2000; Wysolmerski J.J., 2012) (рис. 2).
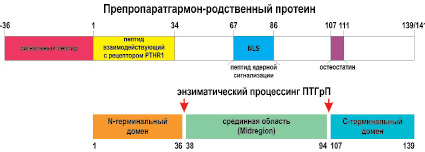
Рис. 2. Возможная схема препаратгормон-родственного протеина и протеолитического процессинга ПТГрП на 3 биологически активных пептида.
Сигнальный пептид включает последовательность препро (-36-1).
N-терминальный домен взаимодействующий с рецептором ПТГ / ПТГрП (PTHR1) (1-34). Срединная область ПТГрП (Midregion) отвечающая за плацентарной транспорт кальция содержит последовательность ядерной сигнализации (NLS) (67-86).
C-терминальный домен содержит последовательность (107-111) (osteostatin)
Различные изоформы молекул ПТГрП содержат различающиеся С-концевые терминалы. N-концевые терминалы изоформ имеют частично гомологичные с ПТГ аминокислотные последовательности, что позволяет им связываться с рецептором ПТГ первого типа (PTH1R) (Campos R.V. et al., 1995). Представлена структура биологически активного NH2-терминального домена ПТГрП человека (1-34), определенная с помощью двухмерной протонной магнитно-резонансной спектроскопии. (Weidler M. et al., 1999). Улучшенная стратегия расчета структуры показала наличие двух спиралей His-5-Leu-8 и Gln-16-Leu-27, связанных гибким линкером. Структура ПТГрП (1-34) и структура человеческого паратиреоидного гормона (1-34) очень похожи, за исключением четко определенного поворота, His-14-Ser-17, присутствующего в паратиреоидном гормоне. Таким образом, сходство аффинности связывания паратиреоидного гормона и ПТГрП с их общим рецептором может основываться на их структурном сходстве.
Семейство биологически активных пептидов генерируется путем альтернативного сплайсинга первичного транскипта, а также за счет использования альтернативных посттрансляционных сайтов расщепления белковых молекул путем протеолитического процессинга. Посттрансляционная модификация путем протеолиза исходных изоформ ПТГрП генерирует образование пептидов, которые функционируют в качестве паракринных эффекторов, имеют короткий период полураспада, а также многочисленные виды биологической активности (Orloff J.J. et al., 1994; Sellers R.S. et al., 2004; Philbrick W.M. et al., 1996). N-концевая область ПТГрП (1-34) содержит аминокислотную последовательность: -H-Ala-Val-Ser-Glu-His-Gln-Leu-Leu-His-Asp-Lys-Gly-Lys- Ser-Ile-Gln-Asp-Leu-Arg-Arg-Arg-Phe-Phe-Leu-His-His-Leu-Ile-Ala-Glu-Ile-His-Thr-Ala-OH. Домен ПТГрП (1-34) способен активировать общий для ПТГ и ПТГрП рецептор (ПТГ/ПТГрП-рецептор) (Strewler G.J., 2000; Mannstadt M. et al., 1999).
Особым биологическим свойством ПТГрП является его локализация в клетке. Пептид может синтезироваться в аппарате Гольджи и локализоваться в цитоплазме либо секретироваться в околоклеточное пространство. ПТГрП генерируется в таких клетках, но не секретируется из нее, а транслоцируется в ядро клетки, где оказывает во многом неясное влияние на ядерные функции (Lam M.H. et al., 2000). Понимание того, как этот белок транспортируется через ядерную оболочку и как регулируются процессы импорта, является важным аспектом понимания функции клеток. Структурная биология сыграла ключевую роль в понимании молекулярных событий во время транспортных процессов и их регулирования, включая распознавание сигналов ядерного нацеливания соответствующими рецепторами. Структурную основу основных путей ядерного импорта и молекулярную основу их регулированияобеспечивают факторы транспорта, являющиеся членами семейства β-кариоферина, которые могут напрямую связывать перемещаемую молекулу (например, импортин-β, транспортин-1, транспортин-3, импортин-13) или через переходные белки (например, импортин-α, симпортин-1), а также несвязанные транспортные факторы, такие как Hikeshi, участвующие в транспортировке белков теплового шока, и NTF2, участвующие в транспортировке RanGDP (Christie M. et al., 2915). Кроме того некоторые клетки используют альтернативные трансляционные инициирующие кодоны для образования белковых молекул предназначенных для ядерной локализации. N-конец молекулы ПТГрП обеспечивает паракринные сигнальные свойства этого белка, тогда как остальная часть молекулы обладает другими функциями, и в том числе связанными с интракринной сигнальной ролью в ядре-нуклеолусе при регуляции апоптоза и пролиферации клеток. Ядерный импорт белков, содержащих классический сигнал ядерной локализации (NLS), включая ПТГрП, импортируются в ядро путем прямого взаимодействия с импортином β. Показано, что внутриклеточно продуцируемый ПТГрП способен перемещаться в зависимости от клеточного цикла и сигнала между ядром и цитоплазмой посредством действия отдельных внутриклеточных транспортных молекул импортин β1 и экспортин 1, опосредующих ядерный импорт и экспорт ПТГрП, соответственно. Вместе пути импорта и экспорта представляют собой интегрированную систему для субклеточной локализации ПТГрП (Lam M.H. et al., 1999) (рис. 3).

Рис. 3. Механизм ядерного импорта ПТГрП включает последовательность ядерной сигнализации (NLS), образующую комплекс с импортином β и Ran-нуклеотидным комплексом RanGDP, состоящим из фермента ГТФаза и нуклеотида гуанозиндифосфата. RanGDP участвует в переносе других белков из цитозоля в ядро в эукариотических клетках. Этот комплекс транспортируется через ядерный поровый комплекс (А) в ядро
Ядерно-нуклеолярный импорт ПТГрП зависит от целостности микротрубочек, а перенос в ядро, частично опосредованный действием импортина β1, осуществляется вдоль микротрубочек. Было показано, что ПТГрП может связываться с РНК. Это означает, что ПТГрП способен выполнять роль нуклеоцитоплазматического челнока и может участвовать в регуляции синтеза и переноса РНК в ядре-нуклеолусе.
ПТГрП индуцирует интракринно свое влияние на различные процессы посредством пептида ядерной локализации (NLS), взаимодействующего с рецептором ПТГрП первого типа (PTH1R), также локализованным в ядре. Эти данные свидетельствуют о ролях системы ПТГ/ПТГрП-PTH1R в регулировании событий в ядре клетки либо на нуклеоскелетоне, либо непосредственно на уровне экспрессии гена (Clemens T.L. et al., 2001; Goomer R.S. et al., 2000; Watson P.H., et al. (2000).