
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

МОЛЕКУЛЯРНЫЕ И КЛИНИЧЕСКИЕ ОСНОВЫ НАСЛЕДСТВЕННЫХ БОЛЕЗНЕЙ
Юров И. Ю., Воинова В. Ю., Ворсанова С. Г., Юров Ю. Б.,
6.1. Молекулярно-генетические методы
Поиск изменений последовательностей нуклеиновых кислот и белков на молекулярном уровне является одним из основных направлений молекулярной генетики. Выявление мутационных изменений ДНК при наследственных заболеваниях и полном отсутствии знания о патогенезе заболевания происходит с помощью молекулярно-генетических методов следующим образом: на первом этапе осуществляется сканирование генома для поиска каких-либо отклонений или соответствующих маркеров. Это проделывается на базе анализа сегрегации болезни в семьях больных, а также поиска аллелей, потенциально связанных с заболеванием, среди больших групп неродственных больных. Далее, выделяются некоторые гены-кандидаты, в которых с высокой долей вероятности могут наблюдаться мутации, связанные с исследуемым заболеванием. Однако, при наличии предположений или некоторых доказательств относительно механизмов, лежащих в основе патогенеза заболевания, первый этап молекулярно-генетических исследований, как правило, опускается.
Таблица 7
Разрешающая способность цитогенетических и молекулярно-цитогенетических методов
|
Метод |
Краткое описание |
Разрешающая |
|
Цитогенетический метод |
Культивирование клеток и последующее дифференциальное окрашивание метафазных хромосом |
5–8 млн |
|
FISH |
Флюоресцентная гибридизация in situ с использованием ДНК зондов на определенные гены, высокоповторяющиеся последовательности и проб, маркирующих полностью хромосому |
от 500–5000 |
|
Классическая метафазная CGH |
CGH с использованием смеси меченых геномной ДНК пациента и ДНК донора |
1,5–10 млн |
|
Серийная CGH (arrayCGH) |
CGH на чипах с использованием смеси меченых геномной ДНК пациента и ДНК контроля |
от 1 тыс. до 1 млн |
|
Олигонуклеотидная серийная CGH |
CGH с использованием смеси меченых геномной ДНК пациента и небольших последовательностей ДНК (олигонуклеотидов) |
около 50 тыс. |
Наиболее известными молекулярно-генетическими методами для поиска генов, потенциально связанных с конкретной болезнью, являются анализы сцепления и аллельной ассоциации. Оба метода преследуют цель картирования генов, аномалии которых приводят к болезни, и основаны на анализе полиморфных генетических маркеров для молекулярного сканирования генома. Эти два метода позволяют проводить молекулярно-генетические исследования в условиях отсутствия знаний о процессах, лежащих в основе патогенеза болезни. Исследование с помощью анализа сцепления требует большого числа индивидуумов из семей с соответствующими больными, в противном случае полученные данные не будут статистически достоверными. При анализе сцепления исследуются полиморфные маркеры с известной локализацией на хромосоме (расположенные в определенных локусах), которые могут наследоваться вместе с болезнью. Если наблюдается совместное наследование (сцепление) болезни и определенных полиморфных маркеров, можно говорить о картировании генов болезни. Картирование представляет собой процесс ассоциации болезни с определенным хромосомным локусом в геноме человека. При аллельных ассоциациях изучается совместное наследование аллелей и заболевания в репрезентативных выборках неродственных больных. Если частота определенных комбинаций аллелей у больных превышает значение в контрольной группе, можно с определенной долей вероятности утверждать то, что в хромосомном (геномном) участке этого аллеля расположен ген, связанный с исследуемой болезнью. Анализ аллельных ассоциаций может указать на генетические факторы патогенеза или предрасположенности к заболеванию.
Существует множество методических подходов к определению генов болезни на базе данных анализа сцепления или аллельных ассоциаций. Среди них наиболее распространенным методом для определения генов, связанных с заболеванием, является выбор наиболее вероятных генов-кандидатов, локализованных в картированном участке, с последующим определением последовательности ДНК этих генов. Такой подход оказался эффективным при идентификации генов болезни Альцгеймера, но, например, при шизофрении, аффективных расстройствах и аутизме этот метод по большей части не дает воспроизводимых результатов. Следует отметить, что классические молекулярно-генетические методы были преимущественно разработаны для системы «один ген – одна болезнь». Это позволяет некоторым исследователям оспаривать результаты многих анализов сцепления и аллельных ассоциаций мультифакторных психических болезней (шизофрения, аутизм и др.). В связи с этим, наиболее подходящим для подобных исследований следует рассматривать анализ всего генома, при котором используются от нескольких сотен до нескольких тысяч полиморфных генетических маркеров.
Существует достаточно большое количество молекулярно-генетических методов, которые имеют широкий спектр применения. Однако многие из них являются либо модификацией, либо комбинацией нескольких основных методов. Среди последних следует выделить полимеразную цепную реакцию (ПЦР) и секвенирование (определение последовательности полимерных макромолекул).
Многие учёные используют в своей работе ПЦР как современный молекулярно-генетический метод. Этот метод позволяет определять небольшие фрагменты последовательностей ДНК. Он также относительно несложен в исполнении и не требует значительных затрат как при адаптации к имеющимся лабораторным условиям, так и в ходе его дальнейшего использования. Классический вариант ПЦР представляет собой искусственную экспоненциальную репликацию или амплификацию небольших фрагментов ДНК в среднем от 200 до 1000 пн. Для использования ПЦР необходимо знать определенную часть исследуемой последовательности ДНК, поскольку для инициации реакции применяются синтетические олигонуклеотиды (как правило, размером около 20 пн) или праймеры. ПЦР для амплификации одного фрагмента ДНК требует использования не менее 2-х праймеров: один – идентичный прямой 5′ последовательности, второй – идентичный обратной 5′ последовательности. Геномная ДНК смешивается с праймерами и ферментом температуро-устойчивой ДНК полимеразы и единичными нуклеотидами (А, Г, Ц и Т), которые являются основой для синтеза новых коротких последовательностей. Смесь нагревается для того, чтобы образовались однонитевые последовательности ДНК (процесс денатурации). Затем, при снижении температуры праймеры связываются с образованными последовательностями, и начинается полимеризация ДНК от 3′ конца на базе единичных нуклеотидов, находящихся в смеси. Данный искусственный процесс не слишком отличается от репликации молекул ДНК в клетке за исключением того, что он происходит с короткими последовательностями. Процесс повторяется много раз, результатом чего является экспоненциальное увеличение концентрации исследуемого фрагмента ДНК по отношению к остальным последовательностям геномной ДНК. Классическая ПЦР может быть использована для получения фрагментов ДНК, которые далее можно исследовать с помощью секвенирования, а также оценить их размеры с помощью метода электрофореза. Последний основан на разделении (в зависимости от размера последовательностей) макромолекул, помещенных в гель, который находится в электрическом поле. Помимо этого, имеются также возможности для количественного определения содержания последовательностей нуклеиновых кислот в реальном времени (ПЦР в реальном времени) или по сравнению с другими последовательностями. Некоторые методы используют предварительную обработку ДНК с последующей амплификацией для выявления изменения последовательности в исследуемом фрагменте. ПЦР может быть также использована для исследования молекул РНК.
Секвенирование позволяет определить нуклеотидную последовательность ДНК. В связи с этим данный метод активно применяется для выявления генных мутаций при моногенных заболеваниях. Наиболее используемый вариант секвенирования известен также как метод Сэнджера. Как правило, перед секвенированием проводят ПЦР с целью увеличения концентрации ДНК фрагмента, последовательность которого необходимо определить. Далее, к однонитевой (денатурированной) молекуле ДНК присоединяется прямой и обратный праймеры и с помощью ДНК полимеразы проводят синтез новой молекулы ДНК на базе дидезоксинуклеозидтрифосфатов и немодифицированных единичных нуклеотидов. В классическом протоколе секвенирования с помощью этого метода предлагается проводить 4 реакции, в каждой из которых реакционная смесь содержит три немодифицированных нуклеотида и один дидезоксинуклеозидтрифосфат. Поскольку полимеризация ДНК будет каждый раз заканчиваться на дидезоксинуклеозидтрифосфате, то в каждой смеси будут находиться фрагменты разных размеров, соответствующие исследуемой последовательности, оборванной на нуклеотиде, замещенном дидезоксинуклеозидтрифосфатом. Затем результаты 4-х реакций анализируются с помощью электрофореза, складывая их, восстанавливается исходная последовательность ДНК. В настоящее время, благодаря созданию высокоразрешающих систем детекции, для секвенирования используются другие способы проведения реакции и анализа конечных результатов. Однако принцип метода остается прежним.
В связи с тем, что при многих наследственных заболеваниях патогенные мутации (в основном, рекуррентные) уже известны, отпадает необходимость использования метода секвенирования для их определения. В данном случае наиболее рационально применение рестрикционного анализа с последующей ПЦР. Этот метод использует способность некоторых ферментов (эндонуклеаз рестрикции или рестриктаз) «разрезать» фрагменты ДНК в зависимости от их последовательности в специфических сайтах. Этот процесс также называется рестрикцией. Для проведения данного анализа ДНК необходимо знать изменение последовательности, чтобы подобрать соответствующую рестриктазу. На первой стадии этого метода проводится рестрикция ДНК, а затем ПЦР фрагмента ДНК, в котором предположительно расположена мутация. Результаты ПЦР также анализируются с помощью электрофореза. В основном, используются такие рестриктазы, которые при условии наличия мутации взаимодействуют с ДНК, образуя два фрагмента различных размеров. Возможен также вариант, когда рестриктазы взаимодействуют с неизмененной последовательностью ДНК, тогда как при мутации рестрикции не происходит (рис. 18).
В ряде случаев возникает необходимость сравнительного анализа содержания фрагментов ДНК. С помощью подобных методов, в основном, исследуют полиморфные последовательности, которые с высокой вероятностью будут отличаться в зависимости от родительского происхождения. Они используются для определения родительского происхождения и диагностики однородительской дисомии, потери/приобретения последовательностей ДНК, а также Х-инактивации при условии предварительной обработки веществами, чувствительными к метилцитозину. Наиболее востребованным для этой цели методом является количественная ПЦР. Данная модификация использует мечение одного из праймеров, благодаря чему амплифицированный участок также становится меченным. Затем, с помощью различных систем детекции можно провести сравнительный количественный анализ ДНК фрагментов одного или нескольких аллелей.
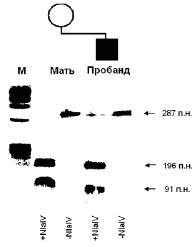
Рис. 18. Результаты рестрикционного анализа с последующей ПЦР мутации R270X в гене МЕСР2 у пробанда с синдромом Ретта и его матери
Взаимодействие ДНК с рестриктазой NlaIV (+NlaIV) показывает наличие мутации у ребенка – дополнительная полоса, соответствующая апмлифицированному участку, необработанному рестриктазой (–NlaIV). У матери в данном случае мутации не обнаружено (М – маркер молекулярного веса для определения размера последовательности ДНК).