
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

Сологуб Т. В., Романцова М. Г., Кремень Н. В., Александрова Л. М., Аникина О. В., Суханов Д. С., Коваленко А. Л., Петров А. Ю., Ледванов М. Ю., Стукова Н. Ю., Чеснокова Н. П., Бизенкова М. Н., Понукалина Е. В., Невважай Т. А.,
2.3.2. Активация процессов липопероксидации – ведущий патогенетический фактор дезинтеграции нервных клеток при ишемии мозга и в процессе его реперфузии. Возможность медикаментозной коррекции свободнорадикального окисления в структурах ишемизированного моз
Расстройство мозгового кровообращения является одной из наиболее частых причин нарушения структуры и функции головного мозга.
Как известно, нарушения церебрального кровотока могут быть следствием системных или локальных сдвигов гемодинамики, таких как гипертензия и гипотензия, тромбоз, эмболия, кровоизлияние, отек и спазм сосудов. Причем, ангиоспазм в сосудах головного мозга имеет типичную локализацию, развивается главным образом в магистральных артериях, в то время как более мелкие ветвления пиальных артерий реагируют на ишемию мозга компенсаторной вазодилатацией [20, 38]. Механизмы компенсаторной вазодилатации, также как и характер метаболических сдвигов в динамике реперфузии предварительно ишемизированного мозга, остаются в значительной мере не изученными.
Несмотря на различие этиологических факторов и пусковых механизмов развития ишемии головного мозга, одним из эфферентных звеньев нарушения структуры и функции нейронов, является образование активных форм кислорода с последующей индукцией свободнорадикальных реакций дестабилизации биологических мембран клеток [20, 49].
Образование активных форм кислорода идет непрерывно и в условиях нормы, а процессы свободнорадикального окисления являются необходимым этапом различных метаболических процессов [20]. Причем, образование активных форм кислорода может происходить в процессе переноса электронов в митохондриальной дыхательной цепи, в реакциях, катализирующих оксидацию, в реакциях микросомального окисления с участием цитохром Р-450, в реакциях неферментативного окисления веществ (гемоглобина, адреналина и др.), в биологических системах с наличием ионов металлов с переменной валентностью и т.д.
Тем не менее, чрезмерное образование активных форм кислорода приводит к активации перекисного окисления липидов (ПОЛ) и соответственно к развитию дезинтеграции биологических мембран - цитоплазматических, лизосомальных, митохондриальных, дефициту АТФ, подавлению энергозависимых реакций в клетках, окислению SH-групп ферментов, инактивации глутатиона и дезорганизации нуклеиновых кислот и белков [38, 49].
В связи с этим очевидна значимость экспериментальных исследований, направленных на изучение состояния процессов липопероксидации и активности антиоксидантных систем ишемизированного головного мозга, а также на изыскание новых эффективных способов медикаментозной коррекции указанных метаболических расстройств.
Целью настоящей работы явилось изучение содержания промежуточных продуктов липопероксидации - малонового диальдегида (МДА) и диеновых конъюгатов (ДК), а также активности супероксиддисмутаза (СОД) и уровня восстановленного глутатиона в гомогенатах ишемизированного мозга и в процессе его реперфузии, а также установить влияние цитофлавина и пирацетама на процессы липопероксидации при ишемии мозга.
Эксперименты поставлены на 50 беспородных белых крысах - самцах массой 250 - 300г. Ишемическое повреждение мозга моделировали частичным пережатием общих сонных артерий.
Сравнительные серии экспериментов проведены:
- в группе интактных животных,
- в группе животных с экспериментальной ишемией мозга без медикаментозной коррекции (введение плацебо),
- в группе животных с экспериментальной ишемией мозга на фоне внутрибрюшинного введения цитофлавина в суточной дозе 1.5 мл/кг 2 раза в сутки,
- в группе животных с экспериментальной ишемией мозга на фоне внутрибрюшинного введения пирацетама в суточной дозе 1.5 мл/кг 20% раствора в течение 3-х суток наблюдения.
Изучение метаболических сдвигов проведено в тканях коры головного мозга спустя 90 мин. с момента развития ишемии мозга, а также в условиях реперфузии головного мозга спустя 24 и 72 часа после снятия зажимов.
О состоянии процессов липопероксидации судили по содержанию в гомогенатах коры головного мозга МДА [47] и ДК [54].
О состоянии свободнорадикального окисления и активности антиоксидантной системы судили по уровню восстановленного глутатиона [16, 41] - активного перехватчика гидроксильных радикалов, и по активности СОД [16], ускоряющей в десятки раз спонтанную дисмутацию супероксидного анион-радикала.
Как показали результаты исследований, уже спустя 90 мин с момента развития ишемии возникала активация процессов липопероксидации в структурах коры головного мозга, о чем свидетельствовало избыточное накопление ДК (р<0.001) и МДА (р<0.001).
Касаясь механизмов развития этого явления, следует отметить, что в условиях гипоксии АФК вступают во взаимодействие с полиненасыщенными жирными кислотами (ПНЖК) - важнейшими компонентами фосфолипидов биологических мембран. Причем, легче всего подвергается свободнорадикальному окислению арахидоновая кислота, имеющая наибольшее количество двойных связей. Отрыв ионов водорода от ПНЖК легче всего происходит в α - положении по отношению к двойной связи, что приводит к перемещению этой двойной связи с образованием ДК [39].
В процессе дальнейшей окислительной дегенерации гидроперекисей липидов в клетке образуются высокотоксичные продукты ПОЛ - альдегиды, кетоны, спирты, накопление которых приводит к гибели клеток [49].
В последующих наблюдениях исследовано содержание промежуточных продуктов липопероксидации в процессе реперфузии головного мозга.
Как оказалось, спустя 24 часа с момента развития реперфузии содержание ДК в гомогенатах мозга нормализовалось (р>0.1), в то время как уровень МДА заметно превышал показатели контроля (р<0.001).
Спустя 3 суток с момента реперфузии мозга уровень ДК в гомогенатах мозга продолжал снижаться не только по отношению к показателям предыдущего периода наблюдения (р<0.01), но и по отношению к показателям контроля. В то же время, уровень МДА продолжил значительно возрастать (р<0.001) как по отношению к показателям предыдущей группы наблюдения (1 сутки реперфузии), так и к уровню МДА на фоне экспериментальной ишемии мозга через 90 мин.
Таким образом, в процессе реперфузии предварительно ишемизированного мозга прогрессировали интенсификация ПОЛ и избыточное накопление высокотоксичного продукта МДА. Последнее убедительно свидетельствует о целесообразности использования в условиях реперфузии предварительно ишемизированных структур мозга антиоксидантов.
Касаясь механизмов активации процессов липопероксидации в ишемизированном мозге, а также в процессе его реперфузии, необходимо остановиться на динамике изменений показателей активности СОД и уровня восстановленного глутатиона при изучении патологии.
Как оказалось, спустя 90 мин с момента развития ишемии мозга активность СОД резко снижалась (р<0.001), спустя 1 сутки с момента реперфузии активность этого фермента оставалась низкой по сравнению с показателями контроля (р<0.001), как и в группе животных с 90 мин ишемией мозга. Лишь к 3 суткам реперфузии активность СОД нормализовалась (р>0.1).
Таким образом, прогрессирующая активация ПОЛ и избыточное накопление МДА в гомогенатах мозга к 3 суткам наблюдения не связаны с недостаточностью дисмутации супероксидного анион-радикала. Как известно, универсальной ловушкой свободных радикалов является восстановленный глутатион, так называемый «тиоловый щит», оберегающий SH - группы структурных и ферментных белков клеток от повреждающего действия окислителей, в том числе и свободных радикалов.
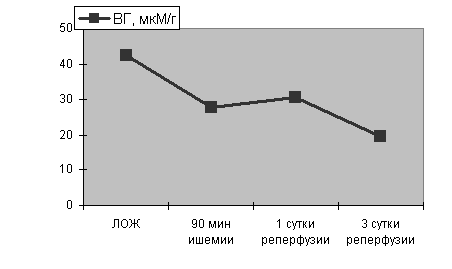
Рисунок 7. Содержание восстановленного глутатиона в гомогенатах ишемизированного мозга и на фоне его реперфузии
Примечание: ЛОЖ - ложнооперированные животные. Степень достоверности полученных данных указаны в тексте.
Как оказалось, спустя 90 мин с момента развития ишемии уровень восстановленного глутатиона в гомогенатах мозга резко снижался по сравнению с показателями контроля (р<0.001), оставаясь на таком же низком уровне и спустя 1 сутки с момента реперфузии (р<0.001). Спустя 3 суток после начала реперфузии уровень восстановленного глутатиона еще более снижался (р<0.001) по сравнению с показателями контроля и предыдущих серий наблюдений.
Причем, была обнаружена отрицательная корреляция между возрастанием уровня МДА и снижением содержанием восстановленного глутатиона в гомогенатах мозга. Полученные данные свидетельствуют о целесообразности включения в комплексную терапию при ишемическом повреждении головного мозга и его реперфузии донаторов SH - групп.
Результаты проведенных исследований позволили сделать следующие выводы:
- 1. Характерными особенностями метаболических сдвигов ишемизированного мозга являются активация ПОЛ, недостаточность антиоксидантной системы и антирадикальной защиты головного мозга, на что указывают накопление в гомогенатах мозга МДА, ДК, снижение активности СОД, уровня восстановленного глутатиона.
- 2. В процессе реперфузии ишемизированного мозга возникают прогрессирующая к 3-м суткам реперфузии активация ПОЛ, недостаточность антиоксидантной системы и антирадикальной защиты мозга, об этом свидетельствуют повышение уровня МДА и снижение уровня восстановленного глутатиона.
- 3. В комплексной терапии патологических состояний, характеризующихся нарушением кровообращения головного мозга, последовательной сменой реакций ишемии и реперфузии, целесообразно использование эффективных мембранопротекторов, антиоксидантов, антиагрегантов, донаторов SH - групп.
В последующих экспериментах с использованием цитофлавина обнаружен положительный метаболический эффект спустя 1 сутки с момента реперфузии ишемизированного мозга. Последний проявлялся значительным снижением МДА (р<0.01), реактивацией СОД (р<0.01) по отношению к таковым показателям группы сравнения без медикаментозной коррекции. Одновременно усиливалась антирадикальная защита мозга, на что указывало резкое возрастание уровня восстановленного глутатиона в гомогенатах мозга (р<0.001), достигающее почти показателей нормы.
Спустя 3 суток с момента реперфузии ишемизированного мозга содержание ДК в гомогенатах мозга резко снижалось (р<0.001) по сравнению с аналогичными показателями предыдущих групп наблюдения, нормализовалась активность СОД (р<0.001). Однако, одновременно резко возрастало содержание МДА (р<0.001) и снижался уровень восстановленного глутатиона (р<0.001) по отношению к таковым показателям группы сравнения без медикаментозной коррекции. Использование цитофлавина в течение 3-х суток реперфузии ишемизированного мозга влияло именно на эти показатели, то есть обеспечивало значительное снижение уровня МДА (р<0.001) и возрастание содержания восстановленного глутатиона (р<0.001) по отношению к таковым показателям групп сравнения без медикаментозной коррекции.
Касаясь молекулярно-клеточных механизмов развития положительных метаболических эффектов цитофлавина в условиях моделируемой нами патологии головного мозга, следует отметить взаимопотенцирующий эффект его компонентов. Так, сукцинат обеспечивает интенсивную диффузию кислорода в различных тканях и стимулирует тканевое дыхание, активизирует сукцинатдегидрогеназное окисление и восстановление цитохромоксидазы [21].В то же время никотинамид является простетической группой кодегидрогеназ - обеспечивающих окислительно-восстановительные процессы. Рибоксин - производное пурина, предшественник АТФ, повышает активность ряда ферментов цикла Кребса, стимулирует синтез нуклеотидов. И, наконец, рибофлавина мононуклеотид - входит в состав ферментов, регулирующих окислительно-восстановительные процессы [1].
Полученные нами данные убедительно свидетельствуют, что цитофлавин является не только антигипоксантом, но и антиоксидантом, поскольку обеспечивает реактивацию СОД ишемизированного головного мозга на фоне его реперфузии, а также повышает антирадикальную защиту головного мозга, препятствуя истощению запасов восстановленного глутатиона.
Таким образом, использование цитофлавина в динамике реперфузии ишемизированного мозга обеспечивает подавление чрезмерной интенсификации ПОЛ, восстановление и антирадикальной защиты клеток при участии восстановленного глутатиона.
Сравнительные серии экспериментов с использованием пирацетама также свидетельствовали о положительных метаболических эффектах спустя 3 суток с момента реперфузии ишемизированного мозга. Пирацетам является ноотропным средством, улучшающим утилизацию глюкозы, микроциркуляцию в ишемизированных зонах мозга, обладает антиагрегационной активностью и широко используется в клинической практике [31].
На фоне применения препарата происходило возрастание уровня восстановленного глутатиона (р<0.001) и снижение уровня МДА по сравнению с таковыми показателями в аналогичный период наблюдения в группе животных без медикаментозной коррекции (р<0.001). При этом активность СОД в гомогенатах мозга на фоне введения пирацетама в указанный период наблюдения была в пределах нормы (р<0.1), а уровень ДК был ниже показателей контроля (р<0.001), как и в группе животных без медикаментозной коррекции (3 суток с момента реперфузии).
Таким образом, метаболические эффекты пирацетама при экспериментальной ишемии мозга и в процессе его реперфузии реализуются за счет более ранней и стабильной реактивации СОД, возрастания уровня восстановленного глутатиона, снижения уровня МДА к 3-м суткам реперфузии ишемизированного мозга.
Изучение биологических эффектов цитофлавина и пирацетама на состояние процессов липопероксидации в структурах головного мозга в условиях его ишемии и реперфузии позволило обнаружить общие для того и другого препарата свойства антиоксиданта и определенные особенности их воздействия на процессы липопероксидации и на антиоксидантную защиту клеток головного мозга.