
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
Лабораторная работа № 4.ПРОВЕДЕНИЕ КУЛОНОМЕТРИЧЕСКИХ ИХ ИССЛЕДОВАНИЙ
Теоретические основы кулонометрии
и кулонометрического титрования
Открытый в 1834 г. Фарадеем закон, устанавливающий зависимость между количеством электричества, необходимым для электрохимического превращения вещества в процессе окисления или восстановления на электроде, и массой образовавшегося продукта, был положен в свое время в основу кулонометрии – метода электрохимического анализа, название которого связано с единицей измерения электрического заряда.
Согласно закону Фарадея, масса выделившегося на электроде вещества (g) пропорциональна суммарному количеству затраченного электричества:
G = N·M = QM/nF, (1)
где N – число молей вещества; М – молекулярная или атомная масса продукта электрохимической реакции; Q – количество электричества в кулонах; n – число электронов, участвующих в электрохимической реакции; F – число Фарадея.
Количество прошедшего электричества можно измерить, подключая кулонометр последовательно с электрохимической ячейкой, в которой проводят электролиз. Однако в аналитической практике этот способ измерения Q применяют редко. Чаще измеряют ток, а не количество электричества. Для определения Q измеряют силу тока, т.е. i = Q/t. Поскольку мгновенное значение тока равно dQ/dt, то количество электричества равно интегралу тока по времени:
 (2)
(2)
Аналитическим стандартом в кулонометрии является постоянная Фарадея. Она представляет собой произведение заряда электрона (1,602·1019 Кл) на число Авогадро (6,022·1023 мол–1) и равна 96487 Кл/моль. Измеряя силу тока или количество электричества, можно установить, какое количество вещества вступило в реакцию на электроде, если, конечно, эта реакция является стехиометрической.
С помощью формулы (2) можно оценить и чувствительность метода. Учитывая, что современные приборы позволяют измерять токи на уровне 10–9 А и ниже, кулонометрическим методом можно определять нанограммовые количества вещества.
Классификация методов кулонометрии
Среди методов кулонометрии различают прямые и косвенные. Последние известны как методы кулонометрического титрования. Для всех методов кулонометрии обязательным является условие, при котором превращение вещества на электроде должно протекать со 100 %-й эффективностью, т.е. со 100 %-м выходом по току. Иначе говоря, внешнее напряжение должно обеспечивать электролиз определяемого вещества и в то же время быть недостаточным для возникновения побочных электрохимических реакций. Это условие означает строгое выполнение пропорциональной зависимости между количеством прошедшего через ячейку электричества и суммарным количеством продукта электролиза.
Выход по току (η) представляет собой отношение количества вещества, выделившегося на электроде в процессе электролиза, к рассчитанному теоретически по закону Фарадея:
 (3)
(3)
Отклонение выхода по току от 100 % может быть обусловлено протеканием побочных процессов: разложением воды, восстановлением или окислением примесей, участием материала электрода в электрохимической реакции и др. Поэтому следует подбирать такие условия электролиза (рН раствора, материал электрода, растворитель, фоновый электролит и т.п.), чтобы выход по току был близок к 100 %.
Если в прямой кулонометрии электрохимическому превращению подвергается определяемое вещество, то в методах косвенной кулонометрии определение количества вещества складывается из электрохимической и химической реакций. Определяемое вещество не участвует в реакции, протекающей на электроде. В ходе электролиза генерируется титрант, который вступает в химическую реакцию с определяемым компонентом в объеме раствора (кулонометрическое титрование с внутренней генерацией). Поэтому в косвенной кулонометрии необходимо иметь способ обнаружения момента завершения химической реакции генерированного на электроде титранта с определяемым веществом. Для установления конечной точки титрования применяют потенциометрический, амперометрический, фотометрический или другие методы.
Кулонометрические титранты в косвенной кулонометрии могут быть получены и вне анализируемого раствора (кулонометрическое титрование с внешней генерацией). В этом случае электролизу подвергают отдельный (внешний) раствор и добавляют его в раствор определяемого вещества. Реакция между ним и генерированным титрантом происходит при смешении анализируемого раствора с раствором титранта.
По технике выполнения определений электролиз можно проводить как при контролируемом потенциале (потенциостатическая кулонометрия), так и при контролируемой силе тока (гальваностатическая кулонометрия).
Содержание определяемого вещества в кулонометрии рассчитывают по величине Q, которая соответствует либо электропревращению определяемого компонента (если он элекроактивен), либо электрогенерациититранта. Последний в необходимом количестве получают на генераторном электроде из воды, растворов солей, кислот, вспомогательных реагентов, твердых электроактивных (рабочих) электродов или амальгам металлов при контролируемом токе (косвенная гальваностатическая кулонометрия), либо при контролируемом потенциале (косвенная потенциостатическая кулонометрия). Преимуществом последнего метода является селективность электродной реакции и возможность последовательной электрогенерации нескольких титрантов при соответствующих значениях потенциала.
Прямая потенциостатическая кулонометрия
Метод основан на контроле за потенциалом рабочего электрода и на поддержании его постоянного значения в течение всего электролиза. Вследствие расхода определяемого компонента при прохождении электрического тока через ячейку его концентрация в объеме раствора непрерывно уменьшается. Это видно из серии вольтамперограмм, полученных в различное время. Постепенное уменьшение предельного тока свидетельствует об уменьшении концентрации определяемого вещества в растворе (рис. 8).
Рассмотрим электролиз вещества Ох с начальной концентрацией СО при потенциале предельного тока Ес, протекающий по схеме:
Ox + ne → Red
В условиях потенциостатической кулонометрии при интенсивном перемешивании ток электролиза (i) в любой момент времени определяется выражением:
i = nFDA C/δ, (4)
где D – коэффициент диффузии Ох; С – концентрация Ох; δ – толщина диффузионного слоя; А – площадь электрода.
Величина i связана со скоростью превращения вещества Ох, dN/dt, при 100 %-й эффективности по току выражением:
i = – nF [dN/dt], (5)
где N – число молей вещества Ох в растворе.
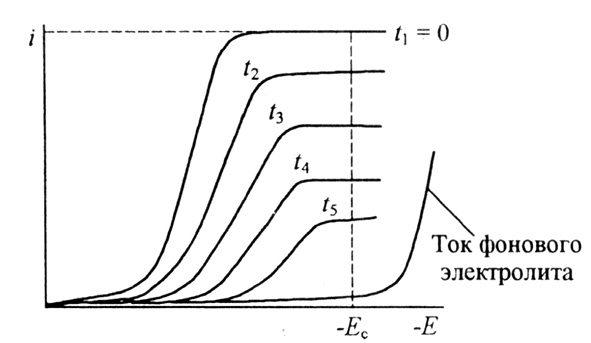
Рис. 8. Кривые ток-потенциал раствора вещества Ох, подвергаемого электролизу различной продолжительности
Последовательность выполнения эксперимента
1. Расплавить эвтектическую смесь состава KCl – NaCl в стеклоуглеродном тигле объемом 40 мл при температуре 750 °С.
2. Включить потенциостат AutolabPGSTAT30.
3. Подключить индикаторный электрод, противоэлектрод и электрод сравнения к соответствующим разъемам на потенциостате.
4. Включить программу NOVA на ПК.
5. Провести кулонометрический анализ расплава
(KCl–NaCl)эвтект. – Na3WO3F3 (3,0·10–4 моль/см3).
