
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
2.2.2 Свойства ионитов
Рассмотрим катионит в его кислотной форме, описываемый общей формулой R-H+, где R – сложный по составу анион катионита, обычно называемый матрицей, а Н+ – связанный с этой матрицей мобильный ион водорода, способный обмениваться на катионы, содержащиеся в жидкой фазе (растворе). Когда катионит входит в контакт с раствором, устанавливается равновесие ионного обмена:
R-H+ + А+ ![]() R-A+ + H+ (58)
R-A+ + H+ (58)
ионит раствор ионит раствор
К этому равновесию приложим закон действующих масс и для него можно написать выражение константы равновесия
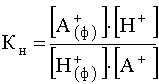 .
.
Здесь индексом «ф» помечены частицы, зафиксированные на катионите, а без индекса – частицы, находящиеся в растворе.
Смысл этой константы равновесия состоит в том, что она количественно характеризует сродство данного катионита к фиксируемому катиону: чем больше это сродство, ![]() тем больше равновесная поверхностная концентрация фиксированных ионитом катионов , тем, следовательно, больше численное значение константы равновесия.
тем больше равновесная поверхностная концентрация фиксированных ионитом катионов , тем, следовательно, больше численное значение константы равновесия.
В случае анионита имеем аналогичное равновесие
R+OH- + B- ![]() R+B- + OH-
R+B- + OH-
ионит раствор ионит раствор
и соответствующее выражение константы равновесия
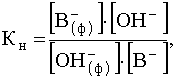 .
.
которая характеризует сродство анионита к анионам, содержащимся в растворе.
Следует учесть, что число фиксированных на ионите ионов ![]() или
или ![]() не может превышать определенного предельного значения, определяемого числом активных центров, имеющихся у ионита. Иными словами, ионит обладает присущей ему ионообменной емкостью. Ионообменная емкость – это количество ионов (моль), зафиксированных в результате ионообмена единицей массы ионита в состоянии насыщения. Этот параметр определяется экспериментально путем обработки известной массы катионита (анионита) в его
не может превышать определенного предельного значения, определяемого числом активных центров, имеющихся у ионита. Иными словами, ионит обладает присущей ему ионообменной емкостью. Ионообменная емкость – это количество ионов (моль), зафиксированных в результате ионообмена единицей массы ионита в состоянии насыщения. Этот параметр определяется экспериментально путем обработки известной массы катионита (анионита) в его ![]() -форме (
-форме (![]() -форме) избытком раствора, содержащего обмениваемый ион, после чего методом титрования устанавливается количество высвободившейся кислоты(катионит) или щелочи (анионит).
-форме) избытком раствора, содержащего обмениваемый ион, после чего методом титрования устанавливается количество высвободившейся кислоты(катионит) или щелочи (анионит).
Заметим, что емкость сильнокислотных катионитов не зависит от рН раствора. В случае же слабокислотных катионитов равновесие ионного обмена смещено в сторону образования формы R-H+ в кислой среде и ионный обмен в этих условиях не происходит.
Разумеется, подобные явления характерны и для анионитов.
Одним из важнейших свойств ионитов является их селективность. Под селективностью ионитов понимают его различную способность фиксировать ионы в зависимости от их природы или, что то же самое, различное сродство ионов к иониту. Селективность ионитов зависит от многих факторов: от природы как ионов, так и ионитов, от заряда ионов, от кислотности раствора. В общем случае бóльшую способность к фиксации ионообменниками проявляют ионы, заряд и поляризуемость которых больше, а радиус гидратированного иона меньше.
На основании экспериментальных исследований были определены ряды селективности ионов, в которых каждый последующий член ряда обладает бóльшим сродством к ионообменнику, чем предыдущий.
Влияние заряда катиона на селективность катионита иллюстрируется следующим рядом:
K+ < Ca2+ <Al3+ <Th4+
Это означает, что реакции, подобные следующей
![]() .
.
практически полностью смещены вправо и катионы Ca2+ , находящиеся в растворе, количественно вытесняют из катионита адсорбированные на нем ионы ![]() , становясь на место последних.
, становясь на место последних.
Для катионов, имеющих одинаковый заряд, ряды селективности имеют следующий вид (для случая сильнокислотного катионита):
Li+<H+<Na<NH4+=K+<Rb+<Cs+<Tl+<Ag+
Ca2+<Be2+=Mn2+<Mg2+<Zn2+<Cu2+=Ni2+<Co2+<Ca2+<Sr2+<Pb2+<Ba2+
Аналогичные ряды построены и для анионов. В этом случае также действует правило, согласно которому многозарядные анионы сильнее присоединяются к иониту, чем малозарядные:
![]() <
< ![]() <
< ![]() <
<![]() .
.
Для сильноосновных анионитов (четырехзамещенные производные ионов аммония) ряд селективности для однозарядных анионов имеет следующий вид:
![]() <
<![]() <
< ![]() <
< ![]() <
<![]() <
<![]() <
< ![]() <
< ![]() <
< ![]() <
< ![]() <
< ![]() <
< ![]() <
<![]() <
< ![]() <
<![]() .
.
