
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.6.3. Области существования ионов и молекул в зависимости от рН cреды и потенциала окислительно-восстановительной системы
![]() Рассмотрим теперь классический пример окислительно-восстановительной полуреакции, где фигурируют кислородсодержащие анионы:
Рассмотрим теперь классический пример окислительно-восстановительной полуреакции, где фигурируют кислородсодержащие анионы:
MnO4– + 8H+ + 5e– D Mn2+ + 4 H2O
В случаях подобного рода влияние кислотности среды очевидно, так как концентрация водородных ионов входит в логарифмический член уравнения Нернста, которое для рассматриваемой полуреакции запишется следующим образом:
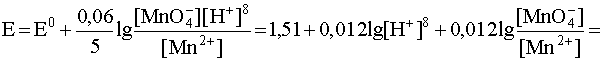 .
.
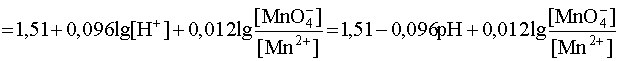 .
.
Данное выражение показывает, что с увеличением рН (уменьшением кислотности среды) окислительные свойства перманганат-иона снижаются. Другой важный вывод, вытекающий из рассмотрения данного примера, заключается в следующем: когда [MnO4–] = [Mn2+] дробь под логарифмом равна 1, следовательно, логарифмический член равен нулю. Тогда потенциал данной системы линейно зависит от рН среды:
E1 = E0 – 0,096pH = 1,51 – 0,096pH
на графике зависимости E1 = f(pH) (рис .5).
Прямая, выражающая эту зависимость, разграничивает две области: над прямой лежит область, где преобладает окислитель, а под прямой – область преобладания восстановителя.
Обобщая рассмотренный случай, запишем уравнение подобной полуреакции в общем виде:
aOx + cH+ + ne– D bRed + dH2O
Уравнение Нернста для этой обобщенной полуреакции имеет вид:
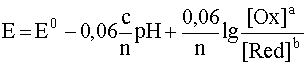 (38)
(38)
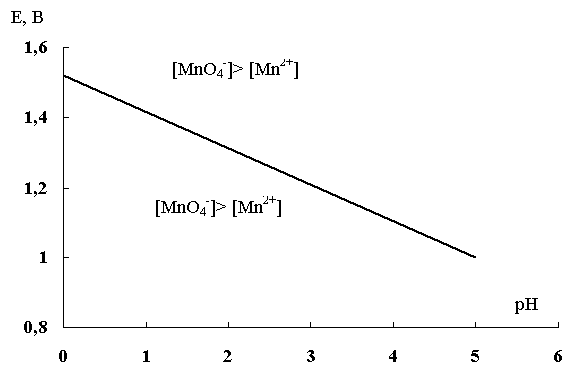
Рис. 5. Области существования окислителя и восстановителя пары Mn2+ / MnO4– в зависимости от рН среды
Графики зависимости E = f(pH) для уравнений полуреакций типа (38) представляют собой прямые линии с тангенсом угла наклона 0,06(c/n). Эти прямые выражают равновесные состояния для рассматриваемой окислительно-восстановительной полуреакции при изменении рН раствора.
Диаграммы Е - рН имеют большое значение в химии водных растворов. Они наглядно показывают, какие химические формы термодинамически устойчивы к окислению-восстановлению и кислотно-основным взаимодействиям в зависимости от рН раствора и окислительно-восстановительного потенциала. В некоторых случаях окислитель и (или) восстановитель рассматриваемой пары могут существовать в нескольких химических формах в зависимости от кислотности раствора. В этом случае важно знать, в каком состоянии существуют окисленная и восстановленная формы данной пары в разных интервалах рН.
В качестве типичного примера рассмотрим систему:
As(V) + 2e– D As(III)
As(V) в зависимости от рН раствора может существовать в виде молекул ортомышьяковой кислоты H3AsO4 или в виде анионов этой кислоты: чем выше кислотность раствора (меньше его рН), тем больше сдвигается равновесие в сторону доминирования в растворе форм, более богатых водородом:
H3AsO4 H2AsO4– HAsO42– AsO43– .
увеличение рН
Соответствующие кислотно-основные пары имеют следующие значения констант кислотности:
| кислотно-основная пара | | | |
| рК | 2,2 | 6,9 | 11,5 |
То же самое относится и к восстановленной форме рассматриваемой системы: As(III) может существовать в виде ортомышьяковистой кислоты H3AsO3 и ее анионов:
| кислотно-основная пара | | | |
| РК | 9,2 | 12,1 | 13,4 |
Для наглядности различные формы существования As(V) и As(III) в зависимости от рН cреды представлены на рис.6 .
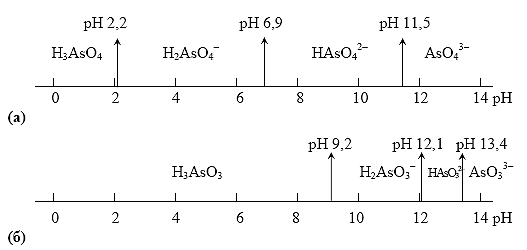
Рис. 6. Области существования различных форм As(V) (а) и As(III)(б) в зависимости от рН среды
Учитывая, что стандартный потенциал пары As(V)/As(III) равен 0,56 В, запишем уравнение рассматриваемой полуреакции и уравнение Нернста для нее при 0<pH<2,2; когда преобладающей формой для окислителя является H3AsO4, а для восстановителя - H3AsO3 (о преобладающих формах в зависимости от рН раствора см. параграф 1.1.3.).
H3AsO4 + 2H+ + 2e– ® H3AsO3 + H2O
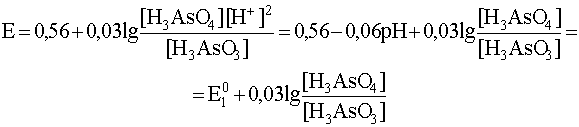 .
.
В интервале 2,2 < pH < 6,9 преобладающей формой окислителя является анион H2AsO4–, а восстановителя – по-прежнему молекула H3AsO3, поэтому уравнение полуреакции в таком случае имеет вид:
H2AsO4– + 3H+ + 2e– ® H3AsO3 + H2O,
а уравнение Нернста для этой полуреакции
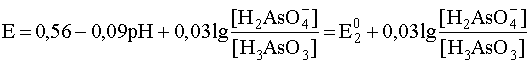 .
.
Подобным же образом напишем уравнения полуреакции и составим уравнение Нернста для других интервалов рН, внутри которых преобладает та или иная форма окислителя и (или) восстановителя:
6,9 < pH <9,2
HAsO42– + 4H+ + 2e– ® H3AsO3 + H2O
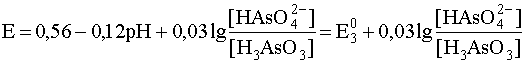
9,2 < pH < 11,5
HAsO42– + 3H+ + 2e– ® H2AsO3– + H2O
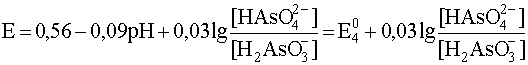
11,5 < pH < 12,1
AsO43– + 4H+ + 2e– ® H2AsO3– + H2O
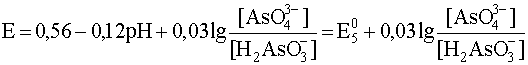
12,1 < pH < 13,4
AsO43– + 3H+ + 2e– ® HAsO32– + H2O

pH > 13,4
AsO43– + 2H+ + 2e– ® AsO33– + H2O
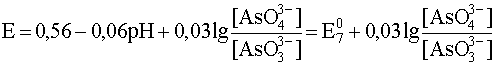 .
.
Диаграмма Е - рН, соответствующая рассмотренному примеру, представлена на рис.7, где проведены прямые, соответствующие потенциалам от Е01 до Е03.
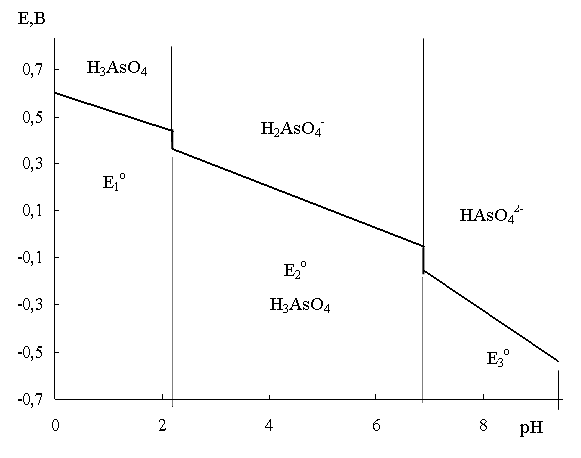
Рис. 7. Формы существования окислителя и восстановителя системы As(V)/ As(III) в зависимости от рН среды и потенциала системы
Кривые Е - рН иногда могут быть использованы для прогноза направления окислительно-восстановительных реакций. Для этого на график наносятся кривые, отвечающие двум взаимодействующим полуреакциям. Окислитель той из них, которая лежит при более высоких значениях потенциала, способен окислить восстановитель полуреакции, которой отвечают более низкие значения потенциала при заданном значении рН. Предположим, нам нужно решить, можно ли окислить иодид-ионы до свободного иода соединениями ванадия (V). Здесь речь идет о взаимодействии двух систем: I2/2I– и V(V)/V(IV). Потенциал первой из этих систем в первом приближении не зависит от кислотности cреды:
I2 + 2e– D 2I–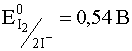 .
.
Уравнение второй полуреакции учитывает, что в кислой среде ванадий (V) существует в виде катионов диоксованадия (V), а ванадий (IV) - в виде оксованадия (IV):
VO2+ + 2H+ + e– D VO2+ + H2O 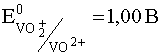 .
.
Потенциал этой последней полуреакции, как следует из ее уравнения, зависит от рН раствора и уравнение Нернста для нее на основании выражения (35) для случая, когда [VO2+] = [VO2+] имеет вид:
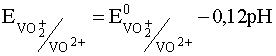 .
.
Из графика на рис.8 следует, что до значений рН »3,8 ванадий (V) в виде катионов VO2+ является окислителем по отношению к иодид-анионам. При более высоких значениях рН свободный иод является окислителем по отношению к V(IV) и может окислить VO2+ до VO2+.
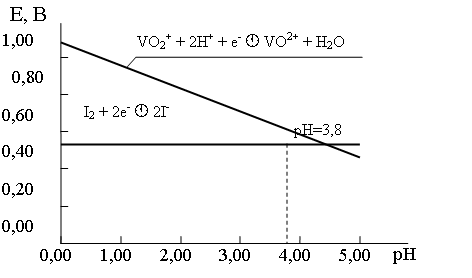
Рис. 8. Зависимость потенциалов систем I2/2I– и V(V)/V(IV) от рН среды
Содержание данного параграфа приводит к следующим важным практическим выводам:
1. Кислотность раствора существенно влияет на свойства окислителей и восстановителей, когда наряду с переносом электронов (окисление-восстановление) имеет место перенос протонов (протолитические взаимодействия).
2. Если в уравнении окислительно-восстановительной полуреакции протоны фигурируют среди исходных веществ, то для усиления окислительных свойств этой системы целесообразно подкисление cреды. В случае, когда ионы Н+ являются продуктами полуреакции, то в раствор следует добавлять щелочь с целью связывания образующихся протонов в молекулы воды.
3. Когда взаимодействующие окислительно-восстановительные системы имеют достаточно близкие значения стандартных потенциалов, необходимо учитывать изменение направления суммарной окислительно-восстановительной реакции при изменении кислотности раствора.
