
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.4.2. Влияние рН раствора на комплексообразование
Приготовим раствор [FeF]2+ с исходной концентрацией С. Если комплекс достаточно прочный, то его исходная концентрация приблизительно равна равновесной, то есть ![]() .
.
С другой стороны, условие электронейтральности раствора требует, чтобы общая концентрация фтора во всех его формах была равна общей концентрации железа во всех его формах, то есть должен соблюдаться материальный баланс:
![]() ,
,
откуда
![]() (19)
(19)
Равновесные концентрации [F–] и [HF] найдем из выражений констант (16) и (17):
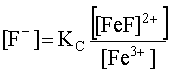 (20)
(20)
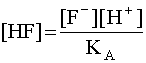 (21)
(21)
Подставим [F–], даваемую уравнением (20), в уравнение (21):
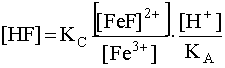 .
.
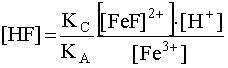 (22)
(22)
Подставим концентрации [F–] и [HF], даваемые уравнениями (20) и (22) соответственно, в уравнение материального баланса (19) и, сделав соответствующие преобразования, получим:
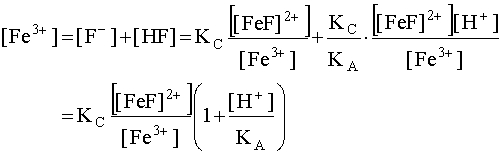 ;
;
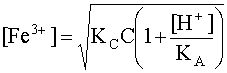 (23)
(23)
Уравнение (23) выражает зависимость концентрации свободных, то есть не связанных в комплекс, катионов комплексообразователя от различных факторов. Иными словами, данное выражение характеризует устойчивость комплекса, так как, чем больше [Fe3+], тем в большей степени комплекс диссоциирован в данных условиях. Уравнение (23) показывает, что устойчивость комплекса обратно пропорциональна его константе нестойкости, его исходной концентрации и кислотности раствора и прямо пропорциональна константе кислотности кислотно-основной пары, в которую входит лиганд.
Анализ уравнения (23) также показывает, что, если [H+] << KA (или, что то же самое pH > pKA), то дробь под знаком корня достаточно мала, поэтому сомножитель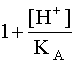 мало отличается от единицы и тогда
мало отличается от единицы и тогда
![]() (24)
(24)
то есть в этих условиях устойчивость комплекса не зависит от кислотности cреды (от рН раствора).
Если же [H+] >> KA (то есть pH < pKA), то в сомножителе 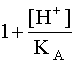 можно пренебречь единицей, и тогда уравнение (23) примет вид:
можно пренебречь единицей, и тогда уравнение (23) примет вид:
 (25)
(25)
В этом случае [Fe3+] возрастает (а, следовательно, устойчивость комплекса уменьшается) с ростом кислотности среды (с уменьшением рН).
Для большей наглядности целесообразно сделанные выводы представить графически, предварительно прологарифмировав уравнения (21) и (22). Пусть исходная концентрация комплекса С=0,1 моль/л. Константа его нестойкости равна 10–5,2, а константа кислотности пары HF/F– KA=10–3,2. Прологарифмируем уравнение (24) с учетом численных значений величин:
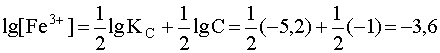 .
.
Прологарифмируем уравнение (25) и выразим из него lg[Fe3+]=f(pH):
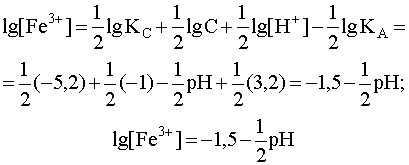 .
.
Если на оси ординат откладывать lg[Fe3+], а по оси абсцисс - рН раствора, то уравнение (24) представляет собой прямую, параллельную оси абсцисс, так как ![]() , а уравнение (25) - прямую, описываемую уравнением
, а уравнение (25) - прямую, описываемую уравнением 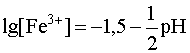 (рис. 4).
(рис. 4).
 .
.
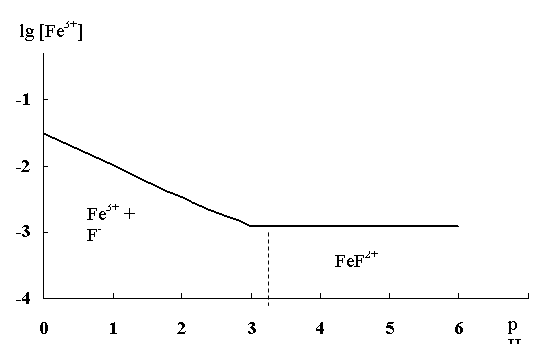
Рис. 4. Кривая зависимости lg [Fe3+] от рH средыдля раствора комплекса [FeF2+] концентрацией 0,1 моль/л
Из приведенного графика следует, что при значениях pH > pKA устойчивость комплекса не зависит от кислотности cреды. В этой области рН комплекс присутствует в растворе в недиссоциированном состоянии [FeF]2+. При подкислении раствора, при pH < pKA комплекс все больше разрушается, и тем в большей степени, чем более кислым является раствор, то есть чем ниже его рН.
Заметим, что, как показывает уравнение (23), на устойчивость комплексов при подкислении их растворов существенное влияние оказывают константы KA и KC.
Влияние первой из них выражается в том, что, чем более основными свойствами обладает анион-лиганд, то есть чем слабее сопряженная с ним кислота, тем при более высоких значениях рН начинается распад комплекса при подкислении его раствора. Например, если лигандом является карбонат-анион СО32–, являющийся довольно сильным основанием с константой кислотности пары НСО3–/ СО32– рКА = 13,2, то уже начиная со значений рН » 13 начинает разрушаться карбонатный комплекс.
Влияние константы нестойкости комплекса КС также весьма существенно: чем меньше эта константа, то есть чем изначально устойчивее растворимый комплекс, тем менее он чувствителен к подкислению раствора. Так, комплексы, имеющие очень малую константу нестойкости, например [Fe(CN)6]3– (KC=10–31), [AlF6]3– (KC=10–24,8) и другие не разрушаются в заметной степени даже при рН = 0.
Все изложенное ранее относилось к тому случаю, когда роль лиганда играют анионы слабых кислот, обладающие более или менее ярко выраженными свойствами оснований. Если же лигандами в комплексе являются анионы сильных кислот (например, Cl–, Br–, I–, NCS– и т.д.), основными свойствами практически не обладающие, то устойчивость этих комплексов от кислотности среды практически не зависит.
