
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.4.1. Исходные положения
До сих пор рассматривались равновесия, в которых от донора к акцептору переносилась одна из частиц: протон, электрон или лиганд. Однако в химической практике часто происходит перенос двух частиц одновременно. В этом случае количественное описание происходящих в растворе процессов базируется на сочетании соответствующих равновесий и относящихся к ним констант.
Начнем рассмотрение этих ситуаций со случая, когда переносятся одновременно протон и лиганд, то есть когда имеет место взаимосвязь равновесий комплексообразования и кислотно-основных. Для этого возьмем простой пример - фторидный комплекс железа (III) [FeF]2+ (при этом, учитывая, что катион-комплексообразователь Fe3+ имеет координационное число, равное шести, будем подразумевать, что остальные пять координационных мест в комплексе заняты молекулами воды, которые для простоты опускаем).
Рассматриваемый комплекс в водном растворе подвергается вторичной диссоциации и этому процессу соответствует константа нестойкости комплекса, которую обозначим KC:
[FeF]2+ D Fe3+ + F–;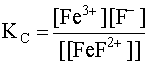 (16)
(16)
Поскольку в роли лиганда здесь выступает анион слабой кислоты HF, он является основанием, способен присоединять протон, а сопряженной с ним кислоте соответствует ее константа кислотности KA:
F– + H+ D HF;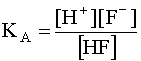 (17)
(17)
Если раствор комплекса постепенно подкислять, добавляя к нему сильную кислоту, то равновесие (17) все больше будет смещаться вправо, вызывая постепенное исчезновение из раствора анионов F–. Это, в свою очередь, повлияет на состояние равновесия (16), так как при уменьшении концентрации F– оно также будет смещаться вправо - в сторону разрушения комплекса [FeF]2+.
С другой стороны, если к раствору фтороводородной кислоты HF добавлять катионы Fe3+, то они, связываясь в комплекс с анионом F–, вызовут уменьшение их концентрации в растворе, равновесие (17) будет смещаться влево, то есть кислота HF будет все более и более диссоциировать.
Сочетание равновесий (16) и (17) приводит к суммарной реакции:
[FeF]2+ + H+ D Fe3+ + HF
Константа равновесия этого процесса
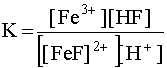 .
.
Умножив и разделив это выражение на [F–], имеем:
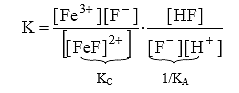 .
.
K=Kc/KA (18)
Вышеизложенное, а также анализ выражения (18), позволяют сделать следующие важные выводы:
1. Если в качестве лигандов комплекса выступают анионы слабой кислоты, играющие роль основания, то подкисление раствора способствует разрушению комплекса.
2. Выражение (18) показывает, что при прочих равных условиях комплекс будет разрушен в тем большей степени, чем меньше его устойчивость в водном растворе (чем больше KC) и чем слабее кислота, сопряженная с лигандом (чем меньше KA).
Итак, проблема наложения равновесия комплексообразования на кислотно-основное равновесие имеет два аспекта - влияние кислотности раствора на устойчивость комплекса и, с другой стороны, влияние комплексообразования на состояние кислотно-основного равновесия. Из этих двух аспектов несравненно большее практическое значение имеет первый, поэтому рассмотрим его подробнее.
