
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.1.3. Области существования различных химических форм в зависимости от рН
Возьмем в качестве примера синильную кислоту HCN, которая в водном растворе представляет собой сопряженную кислотно-основную пару ![]() :
:
HCN + H2O D CN– + H3O+; pK = 9,3
Если к раствору HCN постепенно добавлять какую-либо сильную кислоту, например, HСl, то равновесие будет смещаться влево, вследствие чего концентрация цианид-анионов будет уменьшаться, а концентрация молекул HCN, не подвергшихся протолизу – возрастать. Напротив, добавление в раствор сильной щелочи (например, NaOH) вызовет смещение равновесия вправо за счет исчезновения катионов оксония. Это приводит к последовательному уменьшению в растворе концентрации молекул HCN и возрастанию концентрации анионов CN–.
Таким образом, в зависимости от кислотности раствора синильная кислота может преимущественно существовать либо в виде молекул HCN (кислая cреда), либо в форме своих анионов CN– (щелочная среда).
Запишем выражение константы кислотности HCN в упрощенной форме, заменив катион оксония протоном:
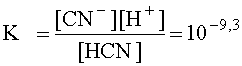 .
.
Это же выражение можно представить и в другом виде:
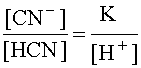 .
.
Если создать в растворе среду, в которой концентрация протонов будет численно равна константе кислотности данной кислоты, то есть. К = [H+] = 10–9,3 или, что то же самое, рК = рН = 9,3, то отношение , при этом [CN–] = [HCN]. Это означает, что при рН < pK (pH < 9,3) в растворе будут преобладать молекулы HCN, а при рН > pK (pH > 9,3) преобладающей химической формой существования синильной кислоты будут ее анионы CN– (см. рисунок 1):
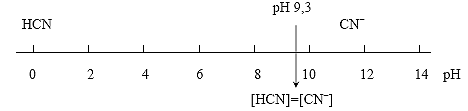 .
.
Рис. 1. Области существования HCN и CN– в растворах синильной кислоты в зависимости от кислотности среды
Этот вопрос имеет особое значение для поликислот, типичным примером которых может служить ортофосфорная кислота Н3РО4, подвергающаяся протолизу в три этапа:
H3PO4 + H2O D H2PO4– + H3O+, pK1 = 2,1
H2PO4– + H2O D HPO42– + H3O+, pK2 = 7,2
HPO42– + H2O D PO43– + H3O+, pK3 = 12,0
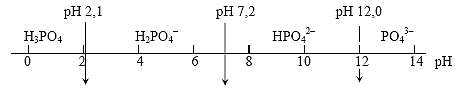
Таким образом, H3PO4 в зависимости от рН раствора может существовать в виде четырех молекулярных или ионных частиц: H3PO4, H2PO4–, HPO42–, PO43–. В сильно щелочных растворах (pH>12) преимущественной химической формой являются ортофосфат-анионы PO43–, концентрации же других форм настолько малы, что в приближенных расчетах ими можно пренебречь. С увеличением кислотности cреды все равновесия постепенно сдвигаются влево, то есть в сторону форм, все более богатых водородом (рис.2).
[H3PO4] = [H2PO4– ] [H2PO4–] = [HPO42–] [HPO42–] = [PO43–]
Рис. 2. Области существования различных форм ортофосфорной кислоты в зависимости от кислотности среды
Знание областей рН преимущественного существования тех или иных форм рассматриваемой кислоты или основания часто помогают упростить расчеты состава водных растворов. Области существования различных химических форм тех либо иных соединений следует учитывать, например, при написании уравнений ОВР.
Часто в справочной литературе можно встретить такую запись восстановительной полуреакции:
NO2– + 2H+ + e– D NO(г) + H2O
Это неправильно, так как при стандартных условиях, когда [H+]=1моль/л (рН=0), анион NO2– не существует. Поэтому более правильно это уравнение надо написать следующим образом:
HNO2 + H+ + e– D NO(г) + H2O
Подобных примеров можно было бы привести бесчисленное множество.
