
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
Глава 4. ВАКЦИНЫ
Среди различных микробных препаратов, применяемых для профилактики, лечения и диагностики инфекционных заболеваний большое место занимают вакцины - биопрепараты, предназначенные для создания активного искусственного иммунитета.
В качестве антигенов вакцины могут содержать убитые или живые микробные тела, либо извлеченные из них химическим путем полные антигены -глюцидо-липоидные полипептидные комплексы. В зависимости от количества антигенов различают моно-, ди-, три-, тетра- и поливакцины.
Для изготовления вакцин применяются такие штаммы микробов, которые удовлетворяют требованиям специальных инструкций по отбору, проверке и хранению культур, применяемых для изготовления вакцин. Изучение и апробация штаммов на предмет соответствия их требованиям инструкций производится Государственным контрольным институтом медицинских биологических препаратов, там же они хранятся в музее живых культур как эталонные, от них отвивают дубликаты и рассылают в сопровождении специального паспорта в институты, изготавливающие вакцины, для использования в производстве. В паспортах, сопровождающих такие штаммы, указываются основные их свойства - морфологические, культуральные, биохимические, антигенные.
Штаммы, полученные из контрольного института, используются в производстве вакцин только после проверки на местах. В производственных институтах проводится большая работа по изучению условий стабилизации свойств штаммов, предназначенных для изготовления вакцин. В настоящее время стабильность свойств культур обеспечивается хранением их в высушенном состоянии в условиях вакуума в запаянных ампулах. Бактериальные культуры, кроме того, можно хранить в пробирках на плотной питательной среде, оптимальной для данного вида микроба. Пробирки в этом случае запаивают, либо заливают пробки расплавленным воском или парафином, чтобы предохранить культуру от высыхания при длительном хранении. Штаммы, хранящиеся в лаборатории, регистрируются в специальных журналах, где записывают паспортные данные, а также результаты текущих проверок, регламентируемых инструкциями.
Требования инструкций к производственным штаммам разных видов и различных групп микроорганизмов направлены к одной цели - обеспечению малой реактогенности, полной безвредности и высокой эпидемиологической эффективности приготовленных из них вакцин. Методы определения этих свойств производственных штаммов в зависимости от того, к какому виду микробов они применяются, имеют специфические особенности, которые отражены в специальной части. В принципе иммуногенность их определяется путем выявления устойчивости животных, иммунизированных опытными вакцинами, приготовленными из этих штаммов, к заражению заведомо смертельными дозами соответствующих культур.
Вирулентность штаммов изучается путем заражения чувствительных животных, чаще всего мышей, и характеризуется заведомо смертельными, минимальными смертельными и 50 %-ными смертельными дозами культур испытуемых штаммов.
Для выявления токсичности животным вводится убитая нагреванием культура производственных штаммов.
Конкретные показатели иммуногенности, вирулентности и токсичности для разных видов микробов определяются инструкциями. Штаммы, обладающие меньшей иммуногенностью и вирулентностью или большей токсичностью, чем это установлено инструкцией, для производства вакцин не применяются.
Таблица 1
Основные типы вакцин

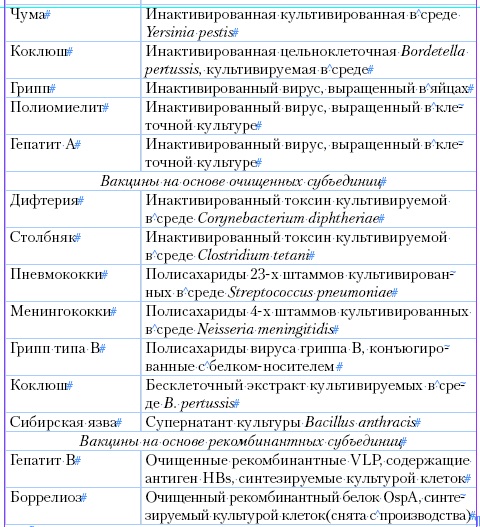
Способы приготовления вакцин отличаются выраженным разнообразием, что связано с особенностями тех микробов, из которых они готовятся. Для удобства изложения целесообразно выделить четыре группы вакцин, которые имеют общие принципы приготовления:
1) вакцины из убитых бактерий;
2) вакцины из инактивированных риккетсий и вирусов;
3) химические вакцины;
4) живые вакцины.
Вакцины из убитых бактерий
Процесс изготовления вакцин из убитых бактерий состоит из следующих операций:
1) заготовка посевного материала;
2) массовый посев и выращивание микробов;
3) сбор и обработка бактерийной массы (инактивирование, консервирование и стандартизация);
4) разведение маточной взвеси для получения вакцины.
Заготовка посевного материала. Материалом для посева обычно служит суточная бактерийная культура - бульонная или агаровая, приготовленная в виде суспензии из штаммов определенного вида, удовлетворяющих требованиям инструкции. Для достижения большей эпидемиологической эффективности некоторые вакцины изготавливаются из нескольких (3-5) штаммов одного и того же вида микробов. Такие вакцины называются поливалентными. Каждый штамм бактерий засевается и выращивается отдельно. Бактерийная суспензия для посева может быть приготовлена из высушенной культуры производственного штамма; в этом случае ампулу вскрывают, сухую бактерийную массу разводят стерильным, физиологическим раствором и используют для посева.
Массовый посев и выращивание бактерий. В настоящее время получение бактерийной массы для изготовления вакцин производят посевом культуры в жидкую питательную среду в специальных котлах-реакторах (новый метод) или массовым посевом на плотную среду в матрацах или четвертях (старым метод). Детали нового метода изложены в разделе культивирования микроорганизмов. Выращивание ведется при оптимальной для данного микроба температуре в течение 12-18-20 часов. Иногда срок инкубации удлиняется.
Сбор и обработка микробной бактерийной массы. По истечении срока культивирования производится сбор бактерийной массы и инактивирование ее. Последовательность этих операций определяется методом выращивания. Так, при использовании жидких питательных сред культура вначале инактивируется в том же реакторе, где производилось выращивание, а затем микробная масса отделяется от жидкой части культуры путем центрифугирования на суперцентрифугах. Если применялись плотные питательные среды, то выросшая на них культура смывается физиологическим раствором и собирается- с помощью сифонной трубки в стерильные градуированные бутыли, в которых затем производится инактивирование культуры.
Как в том, так и в другом случаях инактивирование осуществляется чаще всего прогреванием микробной взвеси при 54-58 °С
(в зависимости от вида микроба) в течение одного часа с постоянным помешиванием. Применяется для этой цели также воздействие химических веществ - формалина, добавляемого в концентраций 0,1-1 %, спирта, мертиолята и других. Полученная - инактивированная, так называемая маточная, взвесь подвергается дальнейшей обработке. После проверки стерильности определяется густота полученной суспензии. Это осуществляется либо путем сравнения со стандартами мутности, изготовляемыми и рассылаемыми производственным институтам Государственным контрольным институтом биологических медицинских препаратов, либо с помощью нефелометра. В настоящее время для целей стандартизации вакцин выпускаются стеклянные стандарты, представляющие собой взвесь мельчайших частиц пирекс-стекла в дистиллированной воде. Они выпускаются в виде набора эталонов различной степени мутности, фотометрически подогнанной к мутности взвеси живых тифозных бактерий определенной концентрации.
Инактивированная и стандартизированная маточная взвесь может сохраняться в хранилище при температуре не выше 8-10 °С 3-6 месяцев; в течение этого времени она должна быть переведена в вакцину.
Маточные взвеси разводятся стерильным физиологическим раствором так, чтобы получить суспензии определенной густоты, установленной для каждого вида вакцин специальными инструкциями. Исходя из общего количества маточной взвеси и ее густоты, рассчитывают необходимое количество физиологического раствора, которое нужно взять для разведения, чтобы получить вакцину нужной густоты. После произведенных расчетов к специально заготовленному физиологическому раствору, содержащему 0,25-0,5 % карболовой кислоты, добавляют необходимое количество маточной взвеси. Густоту полученной суспензии проверяют и окончательно коррегируют, если в этом есть необходимость, по стандартам мутности.
Для получения серии, которая должна содержать несколько разных антигенов, смешивают исходные маточные взвеси разных видов в количествах, определяемых густотой каждой взвеси и тем соотношением микробов, которое установлено для готовой вакцины.
Каждый этап обработки вакцины заканчивается контролем стерильности. В качестве консерванта к вакцине добавляют химически чистую карболовую кислоту (0,5 %) либо мертиолят (1:10000). Помимо проверки стерильности и соответствия стандарту, на разных этапах приготовления контролируют безвредность, иммуногенность и переносимость вакцин. Детали проведения этих контролей изложены в разделе контроля препаратов вообще и в частном разделе применительно к особенностям каждой вакцины. Проконтролированные вакцины передаются в РФО, где разливаются и фасуются в соответствии с положениями инструкции по выпуску каждого вида вакцины.
Вакцины из убитых бактерий применяются для профилактики брюшного тифа, паратифов А и В, дизентерии, холеры, лептоспирозов, коклюша. К их числу могут быть присоединены вакцины, применяемые для лечебных целей, при некоторых хронических и вяло протекающих инфекциях, как то: бруцеллез, туляремия, дизентерия, гонорея, коклюш. При некоторых гнойных заболеваниях применяются стафилококковые и стрептококковые вакцины, которые иногда рекомендуют готовить из штаммов, выделенных от больного. В таких случаях препарат называют аутовакциной.
Вакцины из инактивированных риккетсий и вирусов
Отличительной особенностью вакцин из инактивированных риккетсий и вирусов является способ накопления микробной массы. Этот процесс осуществляется путем заражения чувствительных животных, членистоногих, куриных эмбрионов или культур тканей, что в деталях изложено в разделе культивирования микробов.
Таким образом, вирусные и риккетсиозные вакцины представляют собой суспензии тканей, в которых размножались микроорганизмы или, если говорить о некоторых вирусных вакцинах - вируссодержащую жидкость, в которой размножались те или иные клетки, инфицированные вирусами.
Процессы приготовления этих вакцин отличаются выраженным своеобразием, определяемым особенностями микроба. В связи с этим в деталях они изложены в соответствующих частных разделах.
К числу инактивированных риккетсиозных и вирусных вакцин относятся вакцины против сыпного тифа, клещевого и комариного энцефалита, геморрагической лихорадки.
Химические вакцины
Описанные до сих пор вакцины в качестве антигенов содержат убитые тела соответствующих микробов. Между тем известно, что из микробных тел химическим путем могут быть извлечены активные, иммуногенные фракции. Использование этих специфических фракций, свободных от балластных веществ клетки, положено в основу приготовления бескорпускулярных химических вакцин.
Извлечение соматических антигенов из микробных тел осуществляется различными методами: экстрагированием трихлоруксусной кислотой, кислотным гидролитом или ферментативным перевариванием микробных тел с последующим осаждением антигена спиртом или сернокислым аммонием и очисткой диализом.
Входящие в состав химических вакцин растворимые антигены адсорбируются на фосфате кальция. Благодаря этому в месте введения вакцины создается «депо» антигена, что удлиняет срок пребывания препарата в организме, повышает иммуногенность и позволяет, следовательно, сократить число прививок. Кроме того, замедленное всасывание снижает реактогенность препарата. Получение химическим путем микробных антигенов представляет ряд преимуществ, так как дает возможность извлекать из культуральной жидкости максимальное количество антигенов и концентрировать их в небольшом объеме.
Живые вакцины
Впервые вакцина, содержащая в качестве антигена живые вирусы, была предложена Дженнером. Это была вакцина против оспы и представляла собой лимфу из пустул, возникающих на вымени коров, больных оспой.
Открытие принципа приготовления живых вакцин принадлежит Л. Пастеру, и, поскольку эти препараты являются наиболее эффективными, этот принцип разрабатывается многими исследователями с целью создания живых вакцин против различных инфекционных заболеваний.
Основной особенностью живых вакцин является то, что они изготавливаются из, так называемых, аттенуированных штаммов, которые утратили свои патогенные свойства под влиянием тех или иных воздействий, но сохранили способность, будучи введенными в организм, приживаться в нем и вызывать иммунологические сдвиги, которые являются характерными для состояния резистентности организма к инфекции.
Такие штаммы можно получить путем селекции, либо с помощью воздействия на микробы различными, неблагоприятными для них факторами (необычной температурой, бактериофагами, антителами, антибиотиками, неблагоприятными питательными средами, проведением через организм животных). В качестве факторов последней могут быть использованы: необычная температура, бактериофаги, антитела, антибиотики, неблагоприятные питательные среды, организм животных.
Получение вакцинных штаммов для вирусных вакцин осуществляется более или менее длительным пассированием микроба через организм животных. Применяемый для изготовления антирабической вакцины фиксированный вирус бешенства, был получен Пастером путем длительного пассирования вируса уличного бешенства, выделенного от больной коровы через мозг кролика. В результате этого микроб, повысив до предела свою вирулентность для кролика при внутримозговом введении, снизил ее до минимума для человека, собак и сельскохозяйственных животных.
В принципе все вакцинные штаммы отличаются значительной утратой вирулентности и сохранением антигенной структуры исходного штамма.
Первый признак - значительная утрата вирулентности не позволяет им вызвать заболевание в организме привитого. Однако, благодаря остаточной вирулентности, они приживаются в нем и вызывают доброкачественное заболевание, так называемую вакцинальную реакцию. Благодаря этому, а также антигенной тождественности с соответствующим возбудителем заболевания, в организме привитого появляются специфические антитела, изменяется реактивность, что выявляется положительными аллергическими реакциями, развивается специфический иммунитет;
Измененные штаммы могут быть названы вакцинными только в том случае, если указанные выше признаки, приобретенные ими, стойко удерживаются, передаются по наследству и если полностью исключена возможность реверсии - возврата к исходному состоянию.
Все живые вирусные вакцины содержат не только специфические антигены соответствующих микроорганизмов, но и элементы разрушенной ими и гомогенизированной в процессе приготовления ткани, в которой они размножались. Так, оспенная вакцина состоит из растертых пустул, развившихся на коже привитого теленка, антирабическая вакцина - из измельченной ткани головного мозга кролика, инфицированного фиксированным вирусом бешенства, гриппозная вакцина содержит аллантоисную жидкость и измельченные аллантоисные оболочки куриного эмбриона и т.д.
В настоящее время, в связи с развитием вирусологической техники, получена возможность накапливать значительные количества вируса in vitro, на размножающихся культурах различных клеток. Вируссодержащая жидкость, полученная таким образом, и является основой для приготовления вакцины. Такие вакцины, освобождение от ненужных элементов тканей, являются препаратами более высокого качества.
Эффективность живых вакцин в значительной степени обусловливается количеством содержащихся в них живых микроорганизмов; по мере отмирания их иммуногенность вакцины снижается. Для стабилизации живых вакцин и удлинения срока годности они выпускаются в сухом виде. Высушивание вакцин производится методом лиофилизации. Срок годности сухих вакцин значительно удлиняется, что дает возможность применять их даже в самых отдаленных районах страны. Правильно высушенные вакцины представляют собой плотные или пористые таблетки полушаровидной формы. Перед употреблением их растворяют в стерильной воде, физиологическом растворе или в смеси физиологического раствора с глицерином. Плохо растворяющаяся вакцина к употреблению не годна.
В настоящее время применяются:
1) живые бактериальные вакцины: против бруцеллеза, чумы, туляремии, туберкулеза, сибирской язвы.
2) живые вирусные и риккетсиозные вакцины: против оспы, гриппа, бешенства, полиомиелита, кори, коревой краснухи и желтой лихорадки.
Живые вакцины имеют неоспоримое преимущество перед аналогичными вакцинами из убитых микробов, в некоторых случаях они являются единственными эффективными профилактическими препаратами.
Ассоциированные вакцины
Применение комплексных препаратов позволяет уменьшить количество прививок и получить при этом иммунологический эффект не меньший, чем при использовании монопрепаратов. В настоящее время проводятся широко поставленные исследования, направленные на разработку ассоциированных вакцин различной сложности.
Изучается возможность комплексирования не только однотипных вакцин, но и препаратов разного типа. В практику уже давно вошли сложные вакцины против кишечных инфекций (ди-, три- и тетравакцины), химические вакцины также представляют собою сложные препараты, состоящие из антигенов нескольких видов микробов и в ряде случаев столбнячного анатоксина. Из области экспериментальной разработки вышли в практику дифтерийно-столбнячный анатоксин (ДС) и коклюшно-дифтерийно-столбнячная вакцина (КДС и АКДС).
Объединение в состав ассоциированных вакцин различных антигенов диктуется эпидемиологической целесообразностью. Так, известно, что дети могут заболевать столбняком, что коклюш является одной из наиболее распространенных инфекций в детском возрасте и что одной из задач, стоящих перед органами здравоохранения, является ликвидация дифтерии. В связи с этим, эпидемиологически вполне целесообразно объединить антигены, создающие иммунитет против этих инфекций в один препарат. Целесообразно также комплексировать анатоксины против столбняка и других анаэробных инфекций и др.
При создании ассоциированных вакцин исследователям приходится учитывать особенности взаимодействия разных антигенов в организме привитого, важное значение имеет количественное соотношение антигенов, входящих в состав ассоциированного препарата. Нерациональное дозирование может снижать ответную реакцию организма к отдельным антигенам, различным по своей иммунологической активности.
Возможность извлечения антигенов из микробной клетки химическими путями, достижения в области очистки их, а также анатоксинов, от балластных веществ с последующей концентрацией действующих начал, открывает перед иммунологами широкие перспективы дальнейшего развития этого, чрезвычайно важное и весьма перспективного раздела прикладном иммунологии.
