
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.2 Основные типы функциональных связей «свойство–заряд ядра» и различных сечениях системы
1.13. Какие свойства химических элементов в зависимости от порядкового номера изменяются: а) периодически б) непериодически? Приведите как можно больше примеров таких свойств.
Почему Д.И. Менделеев назвал свой закон периодическим?
Какие факторы могут ограничивать действие Периодического закона?
1.14. Вопреки собственной формулировке, Д.И. Менделеев поставил в системе теллур перед иодом, а никель nepeд кобальтом. Обоснуйте расчетом эти перестановки, зная изотопный состав природных элементов и атомные массы (А) отдельных изотопов (табл. 3):
Кобальт: 59Со(100%), А=58,93 а.е.м.,
Иод: 127I(100%), А=126,90 а.е.м.
Таблица 3
|
Никель |
Теллур |
||||
|
Изотоп |
Содержание в природном элементе, % |
А |
Изотоп |
Содержание в природном элементе % |
А |
|
58Ni 60Ni 61Ni 62Ni 64Ni |
67,88 26,23 1,19 3,66 1,08 |
57,93 59,93 60,93 61,93 63,93 |
120Te 122Te 123Te
124Te 126Te 128Te 130Te
|
0,09 2,46 0,87 4,16 6,99 18,71 31,80 34,90 |
119,90 121,90 122,90 123,90 124,90 125,90 127,90 129,90 |
1.15. Орбитальные радиусы атома марганца и некоторых его катионов имеют следующие значения, нм:
Мn : 0,128; Мn2+: 0,039; Мn4+: 0,038.
Как можно объяснить:
а) уменьшение радиусов при переходе от Мn к Мn4+?
б) значительно более резкое уменьшение радиуса при переходе от Мn к Mn2+,чем при превращении Мn2+ в Мn4+?
1.16. Не пользуясь справочными данными, предскажите изменение радиуса частиц при следующих превращениях:
а) Bi5+→Bi3+→Bi→Bi3-,
б) C4-→ C→C4+.
Обоснуйте ответ.
1.17. Пользуясь справочными данными приложения, представьте графически на одном и том же графике зависимость орбитальных радиусов элементов 2-го и 3-го периодов от порядкового номера элемента и поясните:
а) Чем можно объяснить общую тенденцию - уменьшение атомных радиусов с увеличением порядкового номера элемента в периоде?
б) Почему радиусы атомов элементов 3-го периода больше, чем атомные радиусы элементов 2-го периода?
в) Почему кривая для элементов 2-го периода имеет монотонный характер, в то время как в 3-м периоде имеет место увеличение атомного радиуса при переходе от Mg к А1?
г) Чем объяснить, что переход oт Li к Be (2-й период) и от Nа к Mg (3-й период) сопровождается очень резким уменьшением радиуса ("s - сжатие"), а уменьшение радиуса в рядах р-элементов обоих периодов происходит значительно медленнее ("р-сжатие")?
1.18. Пользуясь справочными данными приложения (табл. 1), постройте графики изменения орбитальных радиусов атомов элементов 4-го и 5-го периодов в зависимости от порядкового номера. Обратите внимание на то, что при сохранении общей тенденции - уменьшение атомного радиуса с ростом порядкового номера в пределах периода - на графиках имеется целый ряд отклонений от монотонности. Попытайтесь дать им объяснение, ответив на следующие вопросы:
а) Выделите на графиках области s-, р и d-сжатия, объясните следующую закономерность: s- сжатие> р - сжатие > d - сжатие.
б) Почему у Сr и Сu (4-й период) атомные радиусы имеют аномально высокие значения?
в) Чем объясняется значительное увеличение атомных радиусов при переходе от последнего d - элемента к первому p - элементу в каждом периоде?
г) С чем можно связать аномально низкое значение атомного радиуса Рd и отсутствие этого явления у Ni, хотя оба элемента находятся в одной и той же подгруппе?
д) Среди р - элементов 4 - го периода Вr «выпадает» из общей закономерности, имея больший атомный радиус, чем у предыдущего элемента (Se). В 5-ом периоде этот максимум отсутствует - атомный радиус I меньше, чем у предшествующего элемента Те. Дайте объяснение этой особенности.
1.19. На рис. 2 представлена зависимость орбитальных радиусов f-элементов 6-го периода от атомного номера, куда включен и лантан, относящийся к d-элементам.
Обратите внимание на общую тенденцию - уменьшение атомных радиусов в ряду лантаноидов, называемое «лантаноидным сжатием» или «f-сжатием». Это явление накладывает существенный отпечаток на свойства как самих лантаноидов, так и элементов, стоящих в системе после них.
Объясните следующие особенности кривой:
а) увеличение радиуса при переходе от La к Сe;
б) ярко выраженный минимум нa кривой, принадлежащий гадолинию;
в) резкое уменьшение атомного радиуса у последнего члена ряда - лютеция.

1.20. Изоэлектронными называют частицы, имеющие одно и то же общее число электронов и одинаковое их распределение на внешнем энергетическом уровне. Так, катионы элементов 3-го периода Na+, Mg2+, Аl3+, Si4+, P5+, S6+, Сl7+ и анионы 2-го периода С4-, N3-, О2- и F- изоэлектронны и все имеют электронную структуру инертного газа неона. Орбитальные радиусы этих частиц имеют следующие значения, нм:
3-й период: Na+ - 0,028; Mg2+ - 0,025; Al3+-0,022;
Si4+ - 0,020; P5+-0,0,18; S6+- 0,017; Cl7+- 0,016.
2-й период: С4- - 0,260; N3-- 0,171; O2- - О,140; F-- 0,136.
Орбитальный атомный радиус неона равен 0,0354 нм.
Представьте графически ход изменения орбитальных радиусов изоэлектронных частиц 2-го и 3-го периодов в зависимости от порядкового номера, проанализируйте ход полученных кривых.
а) Чем объяснить монотонное уменьшение радиусов изоэлектронных частиц как третьего, так и второго периодов?
б) Почему все изоэлектронные катионы элементов 3-го периода меньше, а все анионы элементов 2-го периода больше атома неона?
в) Какое принципиальное отличиe наблюдается в ходе двух кривых и чем его можно объяснить?
г) Напишите формулы всех катионов и анионов s- и р-элементов, изоэлектронных аргону. Предскажите приблизительный ход кривых, выражающих изменение радиусов изоэлектронных катионов и анионов в зависимости от порядкового номера элемента.
д) Большинство катионов и анионов, о которых идет речь в условии данной задачи, реально не существует, а между тем их орбитальные радиусы известны. Как это объяснить?
1.21. Что такое кайно- и некайносимметричные орбитали и электроны? Приведите примеры кайносимметричных и некайносимметричных орбиталсй. Укажите в Периодической системе места, где расположены атомы, содержащие кайносимметричные орбитали в нормальном (невозбужденном) состоянии. Каковы особенности пространственного распределения электронной плотности кайносимметричпых орбиталей?
1.22. Представьте графически изменение первого потенциала ионизации (I1) от атомного номера (z) для элементов 2-го периода, пользуясь справочными данными приложения (табл. 3). Проанализируйте полученный график и ответьте на следующие вопросы:
а) Какова общая тенденция изменения I1 от атомного номера?
б) Чем объясняется уменьшение I1 при переходе от Be к В и от N к О?
в) График I1 = f(z) как бы распадается на три прямые, отличающиеся друг от друга углом наклона. Что, с точки зрения электронного строения, объединяет элементы, лежащие на одной и той же прямой?
г) Постройте аналогичный график для элементов 3-го период. Сохраняются ли отмеченные закономерности для этого периода?
д) Сопоставьте полученные графики с кривыми rорб = f(z) для соответствующих периодов. Обсудите вопрос о взаимосвязи величин орбитальных радиусов атомов и их первых потенциалов ионизации
1.23. Пользуясь справочными данными приложения (табл. 3), нанесите на график зависимость n-го потенциала ионизации для атома титана, взяв первые пять потенциалов ионизации ((I1, I2, I3, I4, I5).
а) Почему на полученном графике наблюдается увеличение потенциалов ионизации с ростом их номера?
б) Чем объяснить наличие перегибов на кривой, наблюдаемых для переходов от I2 к I3 и от I4 к 15?
в) Не прибегая к справочным данным, предскажите номера потенциалов ионизации, для которых можно ожидать резкое увеличение их численных значений для следующих атомов: a) S; б) As; в) Те.
1.24. Постройте графики изменения первого и второго потенциалов ионизации от атомного номера для s-элементов первой группы: I1 = f(z) и I2 = f(z). Обратите внимание на различный ход кривых. Дайте возможные объяснения различиям, в частности, с точки зрения кайносимметрии. Объясните весьма резкое уменьшение I2 при переходе от Li к Na, в то время как на кривой I1 = f(z) этот переход значительно менее резкий.
1.25. В 1973 году Либман установил, что сумма первых потенциалов ионизации для двух непереходных (т. е. s- или р-) элементов одного и того же периода, у которых сумма валентных электронов равно восьми, удивительно мало изменяется в пределах периода. Например, для вторoгo периода
I1(Li) + I1,(F) = 5,4 + 17,4 = 22,8 эВ;
I1(Be) + I1(O) = 9,3 + 13,6 = 22,9 эВ;
I1(B) + I1(N) = 8,3 + 14,5 = 22,8 эВ;
I1(C) +I1(C) -11,3 +11,3=22,6 эВ;
Проверьте, выполняется ли эта закономерность для непереходных элементов 3-го и 4-го периодов, и объясните, это явление.
1.26. Пользуясь справочными данными приложения (табл. 4), постройте и проанализируйте график зависимости сродства к электрону атомов элементов 2-го периода от атомного номера элемента. Обратите внимание на сложный вид зависимости, имеющей как максимумы, так и минимумы. Объясните причины этих экстремумов на основании особенностей электронного строения соответствующих атомов.
1.27. На рис. 3 представлена зависимость сродства к электрону d-элементов 4-го периода (куда включен и Са) от атомного номера. Кривая имеет характерный вид, ее иногда называют «двугорбой».
а) Объясните ход кривой с обоснованием положения на ней каждой точки.
б) Почему вторая половина кривой (после Мп) лежит выше, чем первая?
в) Как следует из графика, элементы Са, Мп и Zn лежат на одной восходящей прямой. Почему? С чем можно связать то, что эта прямая имеет именно восходящий характер, т. е. FСа<FMn.<FZn?
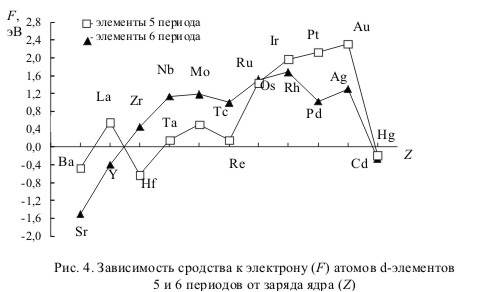
1.28. На рис. 4 приведена зависимость сродства к электрону от атомного номера для переходных элементов 5-го и 6-го периодов (с включением в эти последовательности соответственно Ва и Sr, не относящихся к переходным элементам, но вплотную к ним примыкающих).
Подробный анализ этих графиков, сопоставление их между собой, а также сравнение с кривой для 3d-элементов (см. предыдущую задачу) позволяет выделить следующие особенности:
а) наличие минимума сродства к электрону у Тc и Re;
б) аномально низкое сродство к электрону у Hf и Pd;
в) несовпадение максимумов на второй половине кривой: y d-элементов 5-го периода он приходится на R h, а у элементов 6-го периода - на Аи.
Объясните перечисленные особенности кривых.
1.29. Воспользовавшись справочными данными, приведенными в приложении (табл. 1 и 2), изобразите на одном и том же графике зависимость ионных (Ме2+) и атомных (Me) орбитальных радиусов s-элементов второй группы в зависимости от атомного номера. Обратите внимание на то, что обе кривые имеют приблизительно монотонный характер и по своему виду весьма похoжи одна на другую. Это означает, что для каждого элемента значение атомного радиуса можно сопоставить со значением ионного радиуса, т. е. график зависимости rион= f(rорб) должен представлять собой в первом приближении прямую линию. Проверьте это предположение, откладывая на оси абсцисс атомные, а на оси ординат - ионные радиусы для каждого элемента. Через полученные точки проведите прямую и ответьте на следующие вопросы:

а) укладываются ли полученные на графике точки на прямую?
6) Чем можно объяснить, что на полученной кривой расстояние между точками, соответствующими Mg и Са, больше, чем расстояние между другими соседними точками?
в) На основании полученного графика представьте зависимость r ион= =f(rат) в форме уравнения прямой линии rион = Arат + B, определив для этого коэффициенты А и В.
г) С помощью полученного уравнения, считая атомные радиусы известной величиной (см. табл. 1 прил.), вычислите ионные радиусы всех элементов рассматриваемой группы и сопоставьте вычисленные значения с табличными. Сделайте заключение о применимости данного сравнительного метода расчета для определения неизвестных величин.
1.30. Отношение (I1+I2+...+In)/n называют средним ионизационным потенциалом (Iср) элемента. Здесь I1 I2 ..., In соответственно первый, второй и n-ный ионизационный потенциал, a n - номер группы, в которой находится элемент. Так, для Li Icp = I1, для Be Icp = (I1+I2)/2 и т. д.
Установлено, что в периодах системы между электроотрицательностью (ЭО) s- и р-элементов по Полингу и корнем квадратным из среднего ионизационного потенциала имеется прямая пропорциональная зависимость вида ЭО=А![]() , где А - коэффициент пропорциональности, зависящий от номера периода.
, где А - коэффициент пропорциональности, зависящий от номера периода.
а) Пользуясь справочными данными приложения (табл. 5), определите коэффициент А для 2-го, 3-го, 4 го, 5-го, 6-го периодов. Сильно ли отличаются полученные значения А друг от друга?
б) Попытайтесь найти объяснение прямой зависимости ЭО непереходных элементов от Icp.
1.31. Некоторые ученые считают, что квантовая теория дала полное объяснение системы элементов. Известный ученый, посвятивший теории Периодической системы многие свои труды, профессор С.А. Щукарев, отмечает некоторую расплывчатость понятия о группах системы и затруднения в размещении по этим группам, например, редкоземельных элементов, платиновых металлов, железа, кобальта, никеля и т. д. По его мнению, не вполне ясно, почему периоды начинаются с заселения в атомах электронных s-вакансий и кончаются сериями р-элементов. По мнению ученого, неожиданным является и результат компьютерных расчетов длины периодов. В частности, в восьмом периоде ожидается не 50 элементов, а только 46, после чего сразу по расчетам должен начинаться девятый период: в него перешли четыре р-вакансии, не заполненные в восьмом периоде.
а) Что же, все-таки, квантовая теория позволила объяснить и что остается до сих пор не вполне ясным? Перечислите все известные Вам факты, не укладывающиеся в традиционные объяснения, основанные на квантовой теории.
б) Появление первых электронов на новых подуровнях, согласно статистической теории Томаса-Ферми, определяется выражением
Zе= Υa (2l +1)3,
где Zе - соответствующий критический атомный номер, принадлежащий элементу, с которого начинается заполнение соответствующего подуровня, l-орбитальное квантовое число и Υa-некоторая константа, численное значение которой равно 0,169.
С помощью этого уравнения вычислите атомные номера элементов, с которых начинается заполнение подуровней 1s, 2р, 3d, 4f, а также порядковые номера еще не открытых элементов, с которых должно начинаться заполнение подуровней 5g и 6h. Совпадают ли расчеты с номерами уже известных элементов?
1.32. Русский ученый Е.В. Бирон, первым изучивший явление вторичной периодичности, на примере реакций окисления водородных соединений элементов главной подгруппы V группы заключил, что «легче всего окисляются и переходят в соединения высшего типа соединения сурьмы и фосфора, затем идут соединения мышьяка, далее - азота и, наконец, висмута: последовательного изменения интенсивности реакции с изменением атомного веса не наблюдается». Этот вывод подтвердился при изучении реакций восстановления: наиболее прочными оказались кислородные соединения фосфора и сурьмы. Е.В. Бирон графически иллюстрирует эти выводы схемой
![]()
«Такой своеобразный ход изменения свойств я и предлагаю назвать вторичной периодичностью в отличие от основной, первичной периодичности элементов, открытой Д. И. Менделеевым», - заключает автор.
В каких группах Периодической системы и для каких свойств элементов наблюдается вторичная периодичность? Проанализируйте этот вопрос, рассмотрев характер изменения термодинамических свойств однотипных соединений (в первую очередь - высших оксидов и фторидов) элементов главных подгрупп IV - VIII групп.
1.33. Воспользовавшись данными табл. 3 приложения, постройте графики зависимости первого (I1), второго (I2) третьего (I3) и четвертого (I4) потенциалов ионизации р-элементов IV группы от атомного номера.
а) Какова общая тенденция изменения ионизационных потенциалов в ряду элементов от углерода до свинца? Чем можнo объяснить эту тенденцию?
б) Почему для любого элемента всегда I1<I2<I4...?
а) Для каких кривых графика наблюдается вторичная периодичность и почему?
г) Представьте графически сумму I1+I2+I3+I4 в зависимости от атомного номера и прокомментируйте полученную кривую.
д) Для потенциалов ионизации I2+I3+I4 вычислите «приведенные ионизационные потенциалы», разделив I2,I3, и I4 соответственно на 2, 3 и 4. Нанесите полученные значения на график.
В каких случаях и почему ход кривой выявляет вторичную периодичность? Почему для приведенных потенциалов ионизации явление вторичной периодичности выражается в более явном виде, чем для I1, I2, I3?
1.34. В табл. 4 приведены, кДж/моль: стандартные энтальпии образования трихлоридов р-элементов III группы из простых веществ (∆Н0298), энтальпии образования газообразных трихлоридов этих же элементов из простых веществ при стандартной температуре (∆Нr,298) и энтальпии образования этих же соединений в газообразном состоянии из свободных атомов при стандартной температуре (∆Нсвг, 298).
Представьте графически изменение каждой термодинамической характеристики для ряда элементов от В до Tl и на основании сопоставления полученных графиков ответьте на следующие вопросы:
а) Чем и почему отличаются друг от друга представленные зависимости?
б) На каком из графиков вторичная периодичность выявляется в наиболее «чистом» виде?
в) Что можно сказать о термической устойчивости и относительной реакционной способности трихлоридов алюминия и индия?
Tаблица 4
|
Энтальпия образования |
BCl |
AlCl3 |
GaCl3 |
InCl3 |
ТlCl |
|
ΔHо298 |
-395 |
-695 |
-524 |
-537 |
-351 |
|
ΔHг |
-401 |
-585 |
-443 |
-371 |
-212 |
|
ΔHсвг, 298 |
-1329 |
-1271 |
-1078 |
-970 |
-756 |
Примечание. При стандартных условиях трихлорид бора - газ, а остальные вещества - твердые тела.
1.35. Замечено, что для бинарных водородных соединений р-элементов вторичная периодичность не проявляется. Убедитесь в этом, построив график изменения стандартных энтальпий образования галоидоводородов ΔHf°, кДж/моль, в зависимости от природы галогена, воспользовавшись данными: HF:- 271; HCI: - 92; HBr: - 36; HI: +26.
Объясните причину излома на полученном графике.
Подтвердите справедливость этого утверждения, воспользовавшись справочными данными для бинарных соединений водорода и элементов других групп р-элементов.
1.36. Теплоты плавления (∆Hпл, кДж/моль) и температуры кипения (tк, C°) галогеноводородов имеют значения, представленные в табл. 5.
Таблица 5
|
Параметр |
HF |
HCl |
HBr |
HI |
|
ΔHпл |
4,58 |
1,99 |
2,41 |
2,87 |
|
tK |
19.5 |
-8,5 |
-67 |
-35 |
Представьте графически приведенные данные. Обратите внимание на сходство обоих графиков. Связан ли ход кривых с явлением вторичной периодичности, или его можно объяснить другими причинами?
1.37. Вторичная периодичность для соединений р-элементов проявляется тогда, когда элемент в соединении находится в своей высшей степени окисления, равной номеру группы, тогда как соединения, содержащие элемент в более низкой степени окисления, вторично-периодической зависимости, как правило, не обнаруживают.
Проиллюстрируйте это утверждение, представив графически изменение стандартных энтальпий образования (кДж /моль) оксидов ЭО и диоксидов ЭО2 элементов от С до Рb,пользуясь данными табл. 6.
Таблица 6
|
Оксид |
С |
Si |
Ge |
Sn |
Pb |
|
ЭО |
- 110 |
- 88 |
- 42 |
- 4,2 |
+ 46 |
|
ЭО2 |
- 393 |
- 878 |
- 552 |
- 581 |
- 267 |
Дайте объяснение этому явлению. Какие из диоксидов ЭО2 имеют наибольшую термическую устойчивость и наименее реакционноспособны? Наиболее реакционноспособны?
1.38. Окислительно-восстановительные реакции, протекающие в водных растворах, являются весьма сложными процессами, представляющими собой совокупность множества стадий и характеризующихся различными, часто, взаимно противоположными энергетическими эффектами. Поэтому даже для однотипных окислительно-восстановительных реакций с участием элементов одной и той же группы явление вторичной периодичности, как правило, затушевывается и не проявляется в явном виде. Однако в некоторых случаях даже для этих сложных реакций можно наблюдать вторично-периодическое изменение окислительно-восстановительных свойств. Это относится, например, к реакциям восстановления высших кислородных соединений р-элементов V группы в кислой среде по схеме:
Э5+ + 2е ![]() Э3+
Э3+
При этом сила окислителя и восстановителя количественно характеризуется величиной стандартного окислительно-восстановительного потенциала Е°, В, соответствующей полуреакции.
Для соединений р-элементов V группы известны стандартные окислительно-восстановительные потенциалы следующих полуреакций:
1) NO3- + 3H+ + 2e ![]() HN02 + H2O; Е° = +0,94 В;
HN02 + H2O; Е° = +0,94 В;
2) Н3РО4 + 2Н+ + 2е ![]() Н3РОз + Н20; Е° = - 0,276 В;
Н3РОз + Н20; Е° = - 0,276 В;
3) H3AsO4 + 2H+ + 2e ![]() HАsO2 + 2H20; Е° = + 0,560 В;
HАsO2 + 2H20; Е° = + 0,560 В;
4) Sb205 + 6H+ + 4e ![]() SbO+ + 3H20; E° = + 0,580 В;
SbO+ + 3H20; E° = + 0,580 В;
5) NaBiO3 + 4H+ + 2e ![]() Bi0+ + Na++2H2О; Е0 > 1,8.
Bi0+ + Na++2H2О; Е0 > 1,8.
а) Представьте графически изменение Е° в ряду элементов от азота до висмута. Проявляется ли на графике явление вторичной периодичности?
6) Основываясь на полученном графике, представьте схематически окислительную способность соединений Э(V) и восстановительную способность соединений Э(II1) подобно тому, как это делал E. В. Бирон (см. задачу 1.32).
в) Объясните причину вторичной периодичности для данного случая.
г) Попытайтесь найти в справочной литературе данные и по ним построить аналогичные графики для окислительно-восстановительных свойств р-элементов других групп в сопоставимых условиях.
1.39. В 1914 году Р. Мейер предложил поместить редко земельные элементы (кроме церия) в III группу Периодической системы элементов в виде «малой Периодической системы». Мейер считал, что внутри редкоземельного семейства имеется собственная, внутренняя периодичность. Он предложил расположить их в три ряда по пять элементов: лантан - европий (кроме церия), гадолиний-эрбий, тулий-лютеций, причем оставил место для двух неизвестных элементе между тулием и эрбием.
Рассмотрите вопрос о внутренней периодичности в ceмействе 4f -элементов. Для этого:
а) постройте график зависимости первых трех потенцийлов ионизации от заряда ядра. Какие степени окисления проявляют лантаноиды? Приведите примеры устойчивых соединений с различной степенью окисления;
б) проследите за характером изменения энергии атомизации, температуры плавления и температуры кипения простые веществ с ростом порядкового номера вдоль периода. Объясните ход кривых.
1.40. Диагональное сходство некоторых элементов проявляется как своеобразный равнодействующий результат увеличения ионизационных потенциалов элементов в горизонтальных рядах системы и их уменьшения по вертикали. В результате получается компенсация этих влияний и, следовательно, функциональное сходство атомов, лежащих на диагонали.
На основании расчета силовых характеристик покажите,что диагональное сходство должно проявляться в парах элементов Li-Mg, Na-Ca, K-Sr, Rb-Ba, Cs-Ra, , Ti-Nb, V-Mo и других (каких еще?) и выражается в явлении изоморфизма.
1.41. Обратные диагональные пары, объединяющие элементы в направлении справа - вниз - налево (например, S-As, Se-Sb, Те-Вi) проявляют определенное сходство в халькогенидах. Природа этого явления не ясна.
а) Приведите как можно больше примеров проявления сходства элементов в указанных парах.
б) Предложите возможные объяснения причин обратно-диагонального сходства.
1.42. Подобие свойств соединений лития и магния проявляется, например, в том, что фторид лития и оксид магния изоморфны. Аналогичные ионы в них имеют весьма близкие радиусы: Li+ : 0,060 нм; Mg2+ : 0,065 нм; F- : 0,136 нм; O2- : - 0,140.
Между тем температуры плавления LiF и MgO соответственно равны 848° С и. 2850° С. Чем объяснить такую большую разницу температур плавления у этих соединений?
У какого из соединений каждой пары (BeF2 и SiO2; CaF2 и СеО2)температурa плавления выше? (Учесть, что соединения каждой пары изоморфны, а радиусы соответствующих ионов близки).
1.43. Рассмотрите диагональное сходство алюминия и бериллия (на примере свойств простых веществ, оксидов, гидроксидов, катионов в водном растворе, фторидов).
Для характеристики степени сходства указанных элементов воспользуйтесь методом графического сопоставления (см. задачу 1.44), для чего соберите как можно больше количественных характеристик этих элементов и их соединений, воспользовавшись необходимой справочной литературой.
Сопоставляя свойства бериллия и алюминия, сравните соответствующие свойства этих элементов и их групповых аналогов (для бериллия-магния, а для алюминия-бора). Где сходство проявляется более явственно: в случае диагонально-сходных элементов или в парах элементов - групповых аналогов?
1.44. Для полуколичественной оценки степени сходства элементов и их соединений можно воспользоваться графическим сопоставлением каких-либо характеристик этих элементов. Так, если по одной координатной оси откладывать количественные характеристики одного элемента, а по другой оси - те же характеристики другого элемента, то при наличии сходства между элементами точки укладываются на одну прямую, причем тем ближе к этой прямой, чем больше степень сходства между элементами.
Воспользуйтесь этим методом, сопоставив стандартные энтальпии образования галидов лития и магния - элементов, лежащих на одной диагонали и, следовательно, проявляющих диагональное сходство.
Энтальпии образования ΔНf0, кДж/моль, галидов Li и Mg:
F Cl Вr I
Li - 612 - 408 - 350 - 271
Mg - 1113 - 648 - 518 -
По оси абсцисс oткладывайте ΔНf0- галидов лития LiГ, а по оси ординат -эквивалентные значения (т. е. Δ Н°/2) соответствующих галидов магния MgГ2.
а) Что можно сказать о сходстве галидов этих двух элементов на основании графического сопоставления?
б) С помощью построенного графика определите приблизительное значение ΔНf° иодида магния, отсутствующее в термодинамических таблицах.
1.45. Если в Периодической системе оставить только s-и р-элементы, кроме инертных газов, то получим, табл.7
Таблица 7
|
Li |
Be |
B |
C |
N |
O |
F |
|
Na |
Mg |
Al |
Si |
P |
S |
P |
|
K |
Ca |
Ga |
Ge |
As |
Se |
Br |
|
Rb |
Sr |
In |
Sn |
Sb |
Te |
I |
|
Cs |
Ba |
Tl |
Pb |
Bi |
Po |
At |
|
Fr |
Ra |
|
|
|
|
|
Здесь пустые клетки принадлежат еще не открытым аналогам соответствующих элементов.
Если эту таблицу повернуть на 45° против часовой стрелки, то в горизонтальных строках окажутся элементы, лежащие на диагональных сечениях такой таблицы. Так (не считая углового элемента фтора), первая диагональ будет включать в себя О и С1, вторая - N, S; Вг и т. д.
Элементы, принадлежащие к одной и той же диагонали, имеют близкие значения первых ионизационных потенциалов и относительных электроотрицательностей, что указывает на их диагональное сходство.
а) Начертите «повернутую» таблицу s- и р-элементов, пронумеруйте диагонали. Для каждой диагонали рассчитайте среднее значение первого ионизационного потенциала и относительной электроотрицательности.
б) Охарактеризуйте сходство элементов, принадлежащих одной и той же диагонали, по следующим признакам:
1) металличность (неметалличность); 2) окислительно - восстановительные свойства простых веществ; 3) кислотно- основные свойства простых веществ и их соединений; 4) электрические свойства простых веществ (диэлектрики, полупроводники, проводники с металлической проводимостью). Где возможно, проиллюстрируйте сопоставляемые свойства уравнениями соответствующих реакций.
в) В каком направлении (в сторону увеличения или уменьшения) изменяются указанные свойства с ростом, номера диагонали?
г) Как изменяются с ростом номера диагонали средние значения первых ионизационных потенциалов и относительных электроотрицательностей - Периодически или монотонно?
д) Начертите другую таблицу, повернутую на 45° по часовой стрелке. Проанализируйте каждую «обратную» диагональ по тем же признакам, что и в пункте б. Какой вид сходства элементов проявляется более явственно: диагональное или обратнодиагональное?
е) Проследите за изменением свойств элементов в «обратных» диагоналях по тем же признакам, что и ранее. Как изменяются эти свойства в пределах каждой «обратной» диагонали?
1.46. Рассмотрите проявление диагонального сходства между литием и магнием на примерах получения и химических свойств оксидов, нитридов, гидроксидов, карбонатов, фторидов, ортофосфатов, перхлоратов.
1.47. Проиллюстрируйте диагональное сходство бора и кремния на примере гидролиза их хлоридов. В чем отличие характера гидролиза хлоридов бора и алюминия, являющихся групповыми аналогами?
1.48. Проведите широкое сопоставление свойств элементов, проявляющих диагональное сходство, пользуясь справочным и монографическим материалом (литий-магний, берилий-алюминий); при этом воспользуйтесь следующим примерным планом сопоставления:
а) физические и химические свойства простых веществ;
б) свойства оксидов и гидроксидов;
в) свойства бинарных соединений: гидридов, нитридов, карбидов;
г) свойства солей (в частности галидов, карбонатов, фосфатов, перхлоратов и т. д.);
д) свойства катионов в водных растворах.
1.49. Наряду с ионными потенциалами Картледжа, представляющими собой отношение валентности иона к эффективному ионному радиусу, сила связи валентных электронов с ядром (атомным остовом) может быть охарактеризована так называемой силовой характеристикой (СХ). Для нейтральных изолированных атомов силовая характеристика равна отношению сродства к электрону к орбитальному радиусу атома γа=F/rа, а для катионов - отношению n-го noтенциала ионизации к орбитальному радиусу γk=In/rn+.
Преимущество СХ перед ионными потенциалами заключается в том, что СХ более объективно характеризует свойства свободных атомов и ионов по следующим причинам:
1) валентность - слишком грубая мера заряда иона, не отвечающая его действительному эффективному заряду. С этой точки зрения она иногда уравнивает ионы, существенно отличающиеся друг от друга по многим своим свойствам, хотя и имеющие близкие эффективные ионные радиусы и одинаковые валентности (например: Тi3+ и As3+; Y3+ и Тl3+ т. д.);
2) ионные радиусы, используемые для расчета потенциалов Картледжа, относятся к ионам в определенных химических соединениях, а отнюдь не к свободным атомам и ионам.
Как ионные потенциалы Картледжа, так и силовые характеристики, позволяя оценить силу кулоновского взаимодействия отрываемого электрона с атомом (или ионом в n-й валентности), очевидно, непосредственно связаны с кислотно-основными свойствами атомов и ионов. Так, все катионы s- и р-элементов в зависимости от величины их СХ можно разделить на щелочные, основные, амфотерные, слабокислотные сильнокислотные. Границы значений СХ, определяющие кислотно-основные свойства катионов, можно принять для щелочных катионов меньше 200, основных - 200-630, амфотерных - 630- 1400, слабокислотных - 1400-3400, сильнокислотных - больше 3400.
В случае d-элементов щелочные катионы вообще отсутствуют. Основными считаются катионы d-элементов с величиной γk менее 490, к амфотерным можно отнести катионы, имеющие γk от 490 до 1000.
На основании выше изложенного:
а) пользуясь табл. 1 и 2 прил, вычислите СХ всех катионов, для которых имеются данные по орбитальным радиусам;
б) в зависимости от величины СХ распределите катионы на щелочные, основные, амфотерные, слабокислотные, сильнокислотные (отдельно для s- и р-элементов и для d -элементов);
в) выразите в процентах долю катионов,относящихся к каждой группе. Распределите эти группы в ряд в порядке уменьшения их многочисленности;
г) сопоставьте СХ для катионов одних и тек же элементов, но имеющих разный заряд. Сделайте вывод об изменении кислотно-основных свойств катионов с ростом их заряда;
д) выберите катионы, имеющие близкие значения силовых характеристик, и на основании справочных данных сопоставьте силу образуемых ими кислот или оснований. В принципе, для таких катионов константы кислотности (или основности) должны иметь близкие значения. Если этот прогноз не оправдывается, приведите возможные объяснения.
