
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

Практикум по спектроскопии. Вода в минералах: Учебное пособие
Шишелова Т. И., Созинова Т. В., Коновалова А. Н.,
4.2. Колебательные спектры OnHm-групп (валентные и деформационные) гидроксилсодержащих соединений
Спектры поглощения ОН-групп. Поверхностные группы ОН-. Гидроксильная группа в спиртах, кислотах и других соединениях даёт характеристические частоты, активные как в спектрах инфракрасного поглощения, так и в спектрах комбинационного рассеяния. Эти частоты будут зависеть от водородной связи, которая объясняется тем, что атом водорода, связанный химической связью (с атомами фтора, кислорода и некоторыми другими) в какой-либо молекуле, может вступать во вторичную, более слабую связь с атомами фтора, кислорода или другими, принадлежащими другой молекуле (межмолекулярная водородная связь), или с другими группами атомов той же молекулы, что и сам атом водорода (внутримолекулярная водородная связь). Следует различать слабые и сильные водородные связи. Для первых характерны больше равновесные длины связей А.....В (например, O.....Н от 2,7 Å и больше), малые энергии (от 2 до 5 кал), небольшое смещение частот колебаний O-H (100-400 см-1). Для сильных связей расстояние А.....В значительно короче (для O.....Н от 2,41 до 2,6 Å), а смещение частот варьирует в пределах 1000-2000 см-1 [2].
Остановимся на интерпретации колебаний поверхностных групп ОН на кремнеземе, силикатах, то есть на минеральных веществах.
Поверхностные группы ОН на этих минералах, в основном, рассмотрены в работах В.Н. Филимонова, В.Ф. Киселева. На поверхности кремнезёма, кроме свободных групп ОН (ν=3750 см-1), существуют группы ОН, связанные водородной связью (ν=8550 см-1), которые начинают удаляться при температуре 200°С, а также гидроксильные группы, возмущенные водородной связью, находящиеся внутри глобул (ν=1650 см-1). При нагревании удаляются вначале связанные гидроксильные группы, затем внутренние. Отдельные гидроксильные группы связаны с поверхностью очень прочно, и удаляются только под откачкой при температуре не ниже 300°С.
Молекулы воды, адсорбированные на поверхности силикатов, согласно представлениям В.Н. Филимонова, В.Ф.Киселева и др., могут образовывать с атомами поверхности донорно-акцепторную связь (координационную связь) - связь между двумя атомами или группой атомов, осуществляемую за счет неподелённой пары электронов одного атома (донора) и свободного уровня другого атома (акцептора). Так, атомы кремния, обладая незаполненной d-оболочкой, способны образовывать донорно-акцепторную связь между своими свободными d-орбитами и неподелённой парой электронов кислорода молекулы воды. Способность образовывать донорно-акцепторную связь имеют и ряд других элементов.
Спектры поглощения OН2, ОН3-групп. Вода представляет собой соединение, обладающее очень интенсивным поглощением в инфракрасной области спектра. Как известно, свободная молекула Н2O имеет три основных нормальных колебания, которым в парах соответствуют частоты в см-1; 1595 (деформационное колебание δ), 3654 (симметричное валентное колебание νs) и 3756 (асимметричное валентное колебание νas).
В спектре жидкой воды Н2O наблюдается ряд полос поглощения, соответствующих указанным основным нормальным колебаниям, а также обертонам и комбинациям составных частот. Полосы поглощения, обусловленные частотами антисимметричных и симметричных колебаний, при записи спектра на стандартных приборах средней дисперсии сливаются в одну широкую полосу, максимум которой имеет значение 3400 см-1. В табл. 2 приведены значения максимумов полос поглощения жидкой воды [2].
Как видно из табл. 2, частоты валентных колебаний молекул воды лежат в области 2700-3650 см-1, а деформационных - в области 1070-1670 см-1.
Таблица 2
Частоты основных колебаний воды
|
Системы |
νOH |
δOH |
γOH |
|
В кристаллической фазе |
3600-3090 |
1660-1580 |
850-650 |
|
Адсорбированных на поверхности |
3580-3300 |
1645-1620 |
|
|
В кристаллогидратах солей кислородных неорганических кислот |
3620-2700 |
1070-1590 |
|
|
В кристаллогидратах галогеноводородных кислот |
3600-2900 |
1670-1590 |
|
|
В кристаллогидратах солей неорганических кислот |
3530-3050 |
1650-1614 |
|
|
В кристаллогидратах других соединений |
3000-3120 |
1670- 1600 |
|
Область около 700 см-1 в инфракрасном спектре жидкой воды принадлежит либрационным (вращательным) качаниям γ молекул воды. Полоса довольно широкая, так как состоит из нескольких полос в связи с тем, что в воде имеется 3 вида молекул: каркасные, гидрофобные и гидрофильные.
Максимумы частот колебаний молекул воды зависят от того, в каких соединениях они находится. В табл. 3 представлено значение этих частот [2]. Для большинства кристаллогидратов, содержащих относительно слабо связанные молекулы воды, характерно присутствие полос валентных колебаний Н2O в области частот ниже 3600 см-1, но не менее 3000 см-1. При этом ширина полосы не превышает обычно 100 см-1.
Таблица 3
Максимумы полос поглощения Н2O
|
Типы колебаний |
Максимумы полос |
|
|
см-1 |
мкм |
|
|
Деформационное δ |
1637 |
6,13 |
|
|
3428 |
2,92 |
|
Комбинированное ν + δ |
5183 |
1,94 |
|
1-й обертон валентного 2н |
6920 |
1,45 |
|
Комбинированное 2ν + δ |
8370 |
1,19 |
|
2-й обертон валентного 3ν |
10262 |
0,98 |
|
Комбинированное 3ν + δ |
1700 |
0,85 |
|
3-й обертон валентного 4ν |
13300 |
0,75 |
В интервале 2100-2300 см-1 может присутствовать слабое поглощение, обусловленное составным тоном - суммарной комбинации и крутильных колебаний молекул воды.
Деформационное колебание δН2O, расположенное в спектре жидкой воды ν~1650 см-1, занимает в большинстве кристаллогидратов узкий интервал спектра между 1670 и 1390 см-1. Присутствие в спектре поглощения полосы δН2O является одним из важных критериев для предположения о наличии кристаллогидратной воды в исследуемом объекте. При растворении воды в различных растворителях положение этих максимумов, а также интенсивность полос поглощения может изменяться.
Спектры поглощения ОН3. Существование ионов гидроксония (Н3О)+ принято рассматривать как конечную стадию процесса переноса протона в сильной связи с полной диссоциацией связи O-Н.
В области деформационных колебаний (Н3О)+ наблюдается довольно узкая и интенсивная полоса вблизи 1700 см-1, частота её колеблется в пределах 1670-1750 см-1. Другое деформационное колебание иона (Н3О)+ расположено вблизи 1150 см-1 (небольшая интенсивность) и возможно наложение других полос.
Полосы валентных колебаний, обнаруживаемые в интервале 3400 - 2700 см-1 и около 2100 см-1, отличаются очень большой шириной и незначительной интенсивностью.
Ион гидроксония был определен только в некоторых минералах и искусственных неорганических соединениях. В ряде сложных минералов присутствие гидроксония допускается пока только теоретически, исходя из известного изоморфизма ![]() , возможного ввиду равенства их ионных радиусов и избыточного содержания воды в минералах, в частности, в гидрослюдах [9].
, возможного ввиду равенства их ионных радиусов и избыточного содержания воды в минералах, в частности, в гидрослюдах [9].
В табл. 4 приведены вычисленные фундаментальные частоты в см -1 и нормированные формы колебаний изолированных молекул воды [2].
Таблица 4
Вычисленные фундаментальные частоты (см-1) и нормированные формы колебаний изолированных молекул воды
|
Параметры |
H2O |
HDO |
D20 |
||||||
|
νэксп, см-1 |
3755,8 |
3656,7 |
1594,6 |
3707,5 |
2726,7 |
1402,2 |
2788,1 |
2671,5 |
1178,3 |
|
νвыч, см-1 |
3756,5 |
3656,1 |
1595,2 |
3709,0 |
2725,6 |
1402,5 |
2784,8 |
2671,8 |
1178,3 |
На рис. 7 приведены интервалы частот ОН, Н2О, Н3О валентных и деформационных колебаний. Колебания ОН групп лежат в интервале частот 3700 - 3650 см-1, при этом полосы частот деформационных колебаний обладают меньшей интенсивностью, чем валентные. Частоты валентных колебаний молекул воды зависят от симметричных и ассиметричных колебаний и ряда других факторов. Деформационные колебания молекул Н2О, НDО, D2О совершаются с частотами около 1600, 1400 и 1200 см-1 , они ýже валентных и слабее по интенсивности.
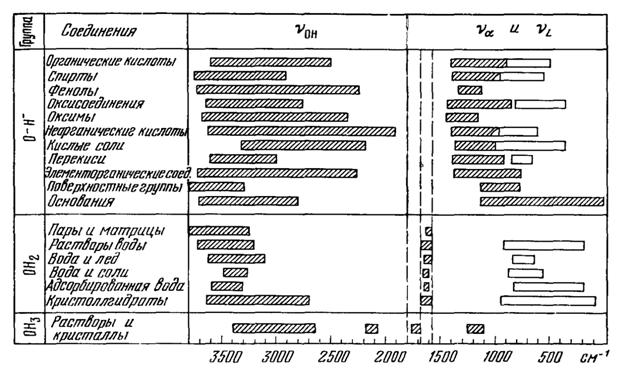
Рис. 7. Характерные интервалы частот ОН-, Н2О- и Н3О- группировок, колебания внутримолекулярные (заштрихованные прямоугольники) и межмолекулярные
(белые прямоугольники) [2]
При ассоциации молекул число полос межмолекулярных колебаний воды, быстро растет от 5 до 20. Но все они лежат в одной и той же области спектра и перекрываются, поэтому маловероятно наблюдать их в отдельности. Гидроксоний ОН3 является наименее изученным из OnHm группировок. В табл. 5 приведены частоты колебаний гидроксония.
Таблица 5
Частоты собственных колебаний иона ОН3+
|
Объект
|
Метод |
Частоты, см-1 |
||
|
νsα |
νEα |
νSOH + νEOH |
||
|
OH3+∙ NО3- |
ИК |
1134 |
1670 |
2650÷3380 |
|
ОН3+∙ I- |
ИК |
1060 |
1705 |
2635÷3350 |
|
ОН3+∙ Вr- |
ИК |
950, 1060, 1150 |
1705 |
2610÷3250 |
|
ОН3+∙ Сr- |
ИК |
1060, 1150 |
1700 |
2590÷3235 |
|
OH3+ ∙ F- |
ИК |
1150, 1048 |
1705 |
2468÷3150 |
|
OH3+ ∙ Cl O4- |
КР |
- |
1590 |
2400÷3600 |
|
OН3+ ∙ Cl O4- |
КР |
1175 |
1577 |
3285 |
|
НС1∙ Н2O |
ИК |
1205 |
1750 |
2900 |
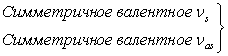 ассоциированы
ассоциированы