
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
4. Влияние поликомпонентности состава на характеристики солевых систем
В таком концентрированном солевом растворе, как рассол, растворённые частицы взаимодействуют между собой, образуя более сложные формы, чем ионные пары. Данные таблицы 6 является результатом компьютерного моделирования действительного состава рассолов минерализации от 60 до 600 г/дм3. За исходные данные для программы HG[1] приняты концентрации элементов, определённые методом ICP-спектроскопии. По данным расчётов можно сравнить формы нахождения различных элементов в рассолах.
В таблице не представлены комплексы и ассоциаты, содержащиеся в незначительных количествах (содержание менее 10-5 г/дм3), такие как RbI, RbOH, Ca(OH)2, KOH, Mg(OH)2, HCl, LiOH, SrOH+, Sr(OH)2.
Таблица 6. Действительный состав рассолов
|
Элемент |
Общая минерализация рассолов, г/дм3 |
||||||||
|
60 |
120 |
200 |
278 |
350 |
423 |
443 |
550 |
600 |
|
|
Концентрация компонента, мг/дм3 |
|||||||||
|
Li+ |
46,43 |
75,83 |
144,68 |
201,41 |
240,115 |
213,53 |
307,85 |
187,3 |
78,485 |
|
Na+ |
1736,4 |
4979,54 |
8289,3 |
12485 |
12069,2 |
11719 |
12851 |
2643,8 |
1087,8 |
|
K+ |
1697,5 |
3329,96 |
6719,9 |
7672 |
8148,2 |
12945 |
7741,9 |
11415 |
11449 |
|
Ca2+ |
10540 |
17225,9 |
28023 |
21700 |
21150,9 |
12018 |
15738 |
7217 |
4136,4 |
|
Rb+ |
1,07 |
1,86908 |
3,75 |
5,2905 |
6,16232 |
6,6996 |
9,0697 |
9,0624 |
8,3594 |
|
Sr2+ |
134,71 |
239,772 |
491,83 |
752,52 |
846,084 |
897,81 |
1173,8 |
2749,7 |
6745,9 |
|
Mg2+ |
1638 |
2663,2 |
4451 |
4632,2 |
4561,28 |
851,28 |
1083 |
2149,7 |
583,9 |
|
Cl- |
15795 |
33024,8 |
60384 |
71685 |
70496,8 |
59883 |
57493 |
48328 |
57184 |
|
Br- |
27889 |
38671,5 |
57559 |
47561 |
47881,7 |
39380 |
48042 |
25764 |
2466,7 |
|
H2O |
1*106 |
1094170 |
793876 |
637302 |
632057 |
776696 |
556031 |
445653 |
39152 |
|
LiCl |
1,73 |
7,13502 |
44,713 |
296,76 |
365,746 |
578,85 |
471,19 |
1421,2 |
2385 |
|
NaBr |
50,517 |
230,714 |
909,89 |
3400,4 |
3451,38 |
4760,8 |
3979,9 |
1828 |
139,55 |
|
NaCl |
133,11 |
874,5 |
3833 |
17172 |
16928,5 |
22162 |
15911 |
9527,2 |
7982 |
|
MgBr2 |
59,468 |
175,989 |
1008,2 |
7535,3 |
8286,22 |
8893 |
621,76 |
16461 |
363,87 |
Окончание таблицы 6
|
MgCl+ |
88,896 |
278,327 |
1008,2 |
5830,3 |
6021,6 |
5480,6 |
407,93 |
8787,1 |
10802 |
|
MgCl2 |
43,775 |
268,06 |
1896,7 |
20373 |
21134 |
20430 |
1053,5 |
47403 |
126212 |
|
KBr |
12,083 |
34,0207 |
125,54 |
198,15 |
217,559 |
357,95 |
187,19 |
285,69 |
17,443 |
|
KCl |
15,947 |
64,5868 |
264,87 |
501,17 |
534,462 |
834,55 |
374,81 |
745,76 |
499,73 |
|
CaBr2 |
556,81 |
2085,37 |
18452 |
82708 |
87679,6 |
139760 |
185369 |
223061 |
5550,1 |
|
(CaCl)+ |
264,83 |
1049,35 |
5871,3 |
20361 |
20273,1 |
27405 |
38696 |
37887 |
52422 |
|
CaCl2 |
67,038 |
519,522 |
5677,9 |
36574 |
36576,2 |
52513 |
51370 |
105064 |
314872 |
|
RbCl |
0,0162 |
0,05832 |
0,2473 |
0,7386 |
0,8653 |
1,039 |
0,9055 |
2,0338 |
4,992 |
|
SrCl+ |
1,9478 |
5,33193 |
15,129 |
47,145 |
53,4701 |
74,643 |
49,718 |
214,38 |
879,52 |
|
SrCl2 |
0,1465 |
0,78448 |
4,3478 |
25,166 |
28,6683 |
42,505 |
19,614 |
176,67 |
1569,9 |
У рассолов, общая минерализация которых достигает 300 г/дм3 , происходит существенная перестройка структуры, свободной (не связанной) воды в них не остается, и доля свободных ионов хлора становится минимальной.
Нами выявлены закономерности изменения содержания стронция, лития, рубидия, калия, натрия и кальция в зависимости от общей минерализации рассолов с применением методов физико-химического моделирования, показывающие наличие экстремумов содержания ионов в интервале минерализаций 350, 450 и 500 г/дм3. Наличие экстремумов в чётко определённой области также свидетельствует о структурной перестройке рассола.
На графиках (рис. 23-34) представлены зависимости содержания макро- и микрокомпонентов рассолов в форме свободных ионов и в связанной форме. Практически для всех микро- и макрокомпонентов концентрации свободных ионов и валовые содержания в рассолах до минерализации 300 г/дм3 остаются одинаковыми (только для кальция и натрия при минерализации рассола 200 г/дм3 эти концентрации незначительно различаются). При достижении рассолом общей минерализации 400 г/дм3 концентрация свободных ионов стремительно снижается для Cl-, Ca2+, Li+ и Na+. Для Rb+ и Sr2+ изменения в валовой концентрации и концентрации свободных ионов не так существенны, то есть они преимущественно находятся в форме свободных, не связанных в соединения, ионов.
Содержание ионов натрия в рассолах возрастает до минерализации 350 г/дм3, а затем снижается (рис. 23-24). Доля свободных ионов с увеличением минерализации уменьшается, т.е. увеличивается степень закомплексованности данного иона.
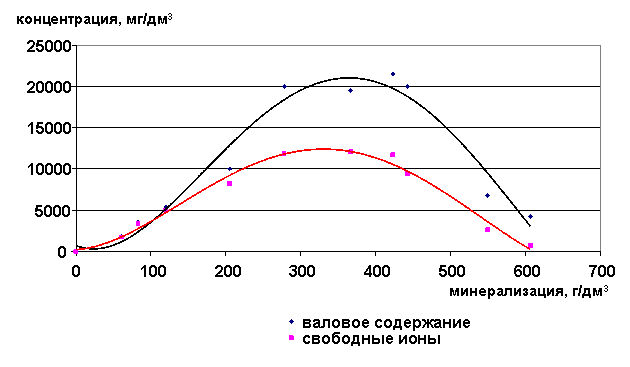
Рис. 23. Зависимость содержания ионов Na+ от минерализации
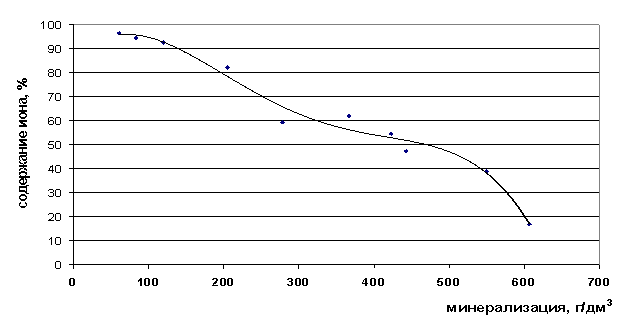
Рис. 24. Зависимость содержания ионов Na+ в свободной форме от минерализации
Валовое содержание ионов лития увеличивается с увеличением общей минерализации рассола, содержание свободных ионов начинает падать после значения Cобщ=350 г/дм3 (рис. 25,26). Такое же значение характерно и для ионов натрия.
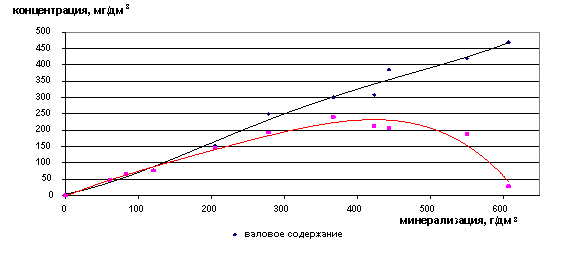
Рис. 25. Зависимость содержания ионов Li+ от минерализации
До границы 140 г/дм3 все ионы лития находятся в форме свободных ионов, после неё происходит снижение процента свободных ионов, в сверхкрепких рассолах с минерализацией 600 г/дм3 степень закомплексованности лития достигает максимума - 95%. В рассолах до минерализации 420 г/дм3 доля свободных ионов лития остаётся высокой - 70%.
![]()
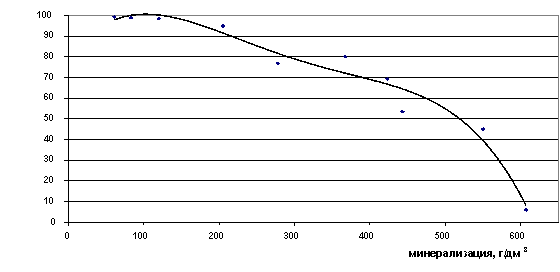
Рис. 26. Зависимость содержания ионов Li+ в свободной форме от минерализации
Валовое содержание ионов кальция растёт с увеличением общей минерализации рассола, а концентрация свободных ионов падает (рис. 27,28). Кальций является хорошим комплексообразующим ионом, поэтому в концентрированных растворах он содержится весь в виде ассоциатов. Переходной границей является минерализация 350 г/дм3, после неё свободных ионов кальция в рассолах почти нет.
![]()
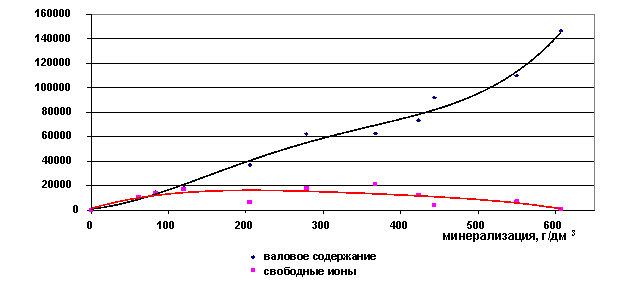
Рис. 27. Зависимость содержания ионов Ca2+ от минерализации
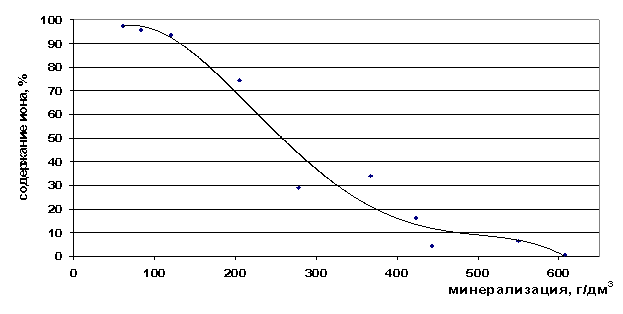
Рис. 28. Зависимость содержания ионов Ca2+ в свободной форме от минерализации
Валовое содержание ионов рубидия возрастает с увеличением общей минерализации рассола, при этом почти весь он находится в форме свободных ионов (рис. 29,30). Рубидий является ценным компонентом, который можно извлекать из рассолов, используя свободную форму нахождения его в рассоле.
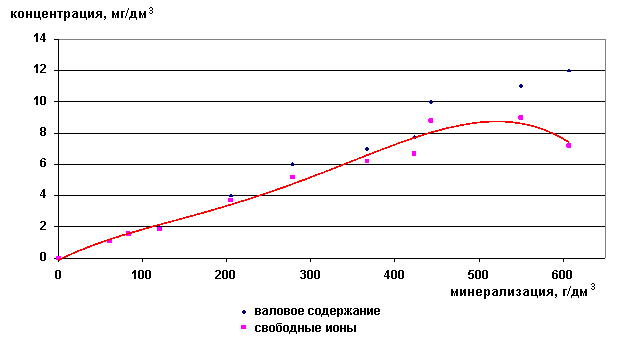
Рис. 29. Зависимость содержания ионов Rb+ от минерализации
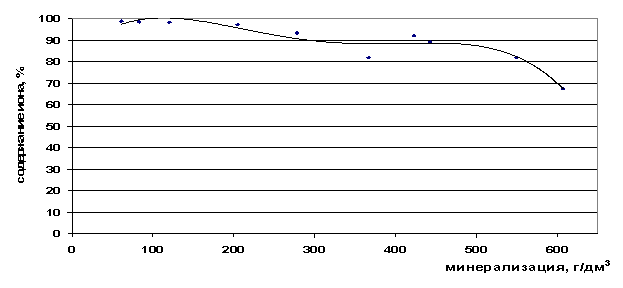
Рис. 30. Зависимость содержания ионов Rb+ в свободной форме от минерализации
Для стронция и калия наблюдается аналогичная зависимость, что и для рубидия (рис. 31,32). Почти все эти компоненты находятся в рассолах в форме свободных ионов. Это особенно важно, т.к. стронций к тому же является промышленно-ценным компонентом.
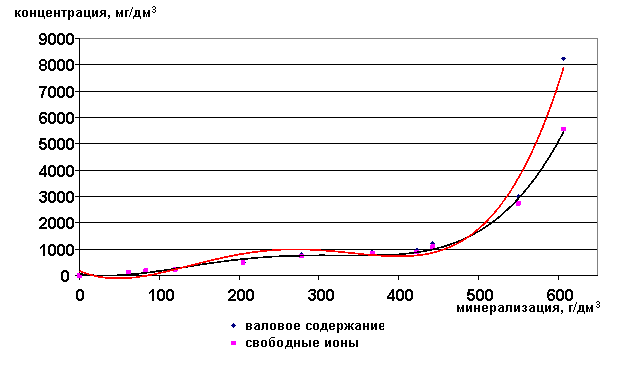
Рис. 31. Зависимость содержания ионов Sr2+ от минерализации

Рис. 32. Зависимость содержания ионов Sr2+ в свободной форме от минерализации
Валовое содержание ионов хлора растёт с увеличением общей минерализации рассола, а концентрация свободных ионов падает. Хлор также как кальций является хорошим комплексообразующим ионом, поэтому в концентрированных растворах он содержится почти весь в виде ассоциатов.
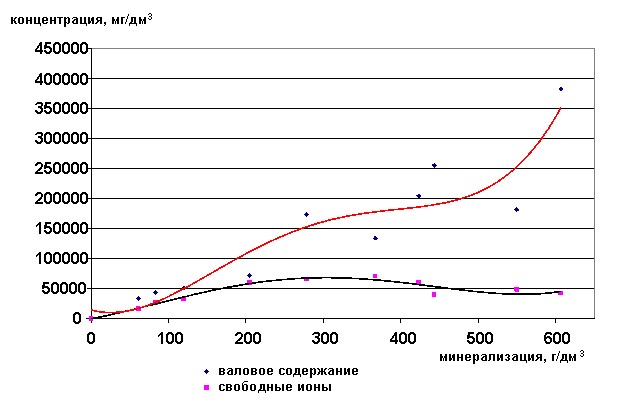
Рис. 33. Зависимость содержания ионов Cl- от минерализации
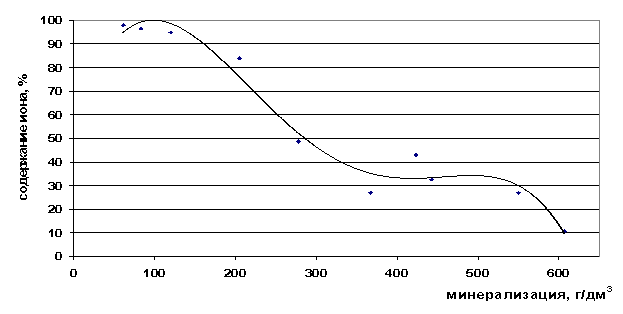
Рис. 34. Зависимость содержания ионов Cl- в свободной форме от минерализации
Обобщая представленные выше результаты, можно отметить, что с ростом минерализации повышается степень закомплексованности кальция (от 2 до 99%), натрия (от 4 до 82%) и лития (от 0 до 95%). Для стронция и рубидия при увеличении минерализации от 60 до 600 г/дм3 степень закомплексованности изменяется по другой зависимости и в численном выражении значительно меньше (от 0 до 30 % для стронция и от 0 до 32% для рубидия). Следовательно, стронций, рубидий и калий в рассолах любой минерализации остаются в основном в виде свободных ионов. А это означает, что существует возможность, используя данные о формах нахождения компонентов в рассоле, разделять ионы с близкими свойствами в крепких и сверхкрепких рассолах, поскольку один из них будет находиться в форме свободного иона, а другой в виде комплекса (например, Ca и Sr, Rb и Na, К и Na в рассоле с Собщ=400-500 г/дм3).
Для процессов извлечения компонентов, где форма нахождения компонента является важным фактором для его выделения в те или иные продукты (ионный обмен, вымораживание, ионная флотация и др.), полученные результаты являются очень ценными. В технологический процесс вступают не простые катионы и анионы, а иные соединения, форму которых мы определили (табл.6). От того, какие соединения будут образовываться в рассоле, будут зависеть не только оптимальные режимы, но и выбор и применимость той или иной технологии [75].
[1] Программа HG (Hydrogeo) разработана в Томском государственном техническом университете профессором М.Б.Букаты и любезно предоставлена авторам для работы
