
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ПАРАТГОРМОН-РОДСТВЕННЫЙ ПРОТЕИН. 2-е издание переработанное и дополненное
Курзанов А. Н., Ледванов М. Ю., Быков И. М., Медведев В. Л., Стрыгина Е. А., Бизенкова М. Н., Заболотских Н. В., Ковалев Д. В., Стукова Н. Ю.,
12.3.3. Абалопаратид
Результатом вышепредставленной огромной работы стало создание нового эффективного остеоанаболического фармпрепарата. Биофармацевтическая компания «Radius Health» разработала фармпрепарат абалопаратид (Abalaparatid), известный ранее как BA058, являющийся рекомбинантным пептидным аналогом человеческого ПТГрП (1–34), который позиционируется как средство для лечения остеопороза и снижения риска переломов в критических анатомических участках скелета (Leder B.Z. et al., 2015). Абалопаратид был выбран для такой терапии на основе доклинических испытаний, которые продемонстрировали способность этого пептида стимулировать образование костной ткани с уменьшенной костной резорбцией и сопутствующей гиперкальциемией по сравнению с наблюдаемым при использовании аналога фрагмента РТН (1–34) (Culler M. et al., 2001; Doyle N. et al., 2013). Разработанный на основе ПТГрП (1–34), абалопаратид был создан стабильным и преодолел потерю анаболического окна и гиперкальциемию, связанную с терипаратидом. Активирующий рецептор домен (аминокислотные остатки 1–21) обоих лигандов одинаков, но для повышения стабильности пептида были сделаны множественные замены между 22–34 аминокислотными остатками ПТГрП. Абалопаратид представляет собой синтетический 34-аминокислотный пептид взаимодействующий с рецептором PTH1R.
Абалопаратид имеет молекулярную формулу C 174 H299 N56 O49 и молекулярную массу 3961 дальтон с аминокислотной последовательностью: H-Ala-Val-Ser-Glu-His-Gln-Leu-Leu-His-Asp-Lys-Gly-Lys-Ser-Ile-Gln-Asp-Leu-ArgArg-Arg-Glu-Leu-Leu-Glu-Lys-Leu-Leu-Ala-Lys-Leu-His-Thr-Ala-NH2 (рис. 16).
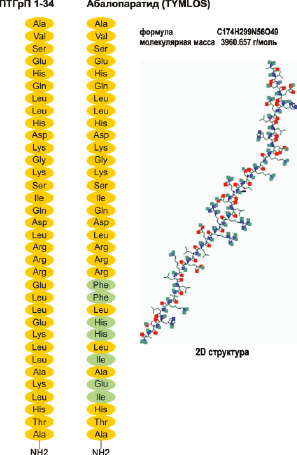
Рис. 16. Структура абалопаратида имеет 41 % гомологии с ПТГ (1–34) и 76 % гомологии с ПТГрП (1–34). Первые 21 аминокислотных остатка идентичны с ПТГрП (1–34), а остальные содержат ряд замен, которые были выполнены для повышения стабильности структуры. Замены аминокислотных остатков обозначены зеленым цветом. Изображение 2D структуры представлено в базе данных открытой химии PubChem (CID 76943386)
Эти структурные особенности абалопаратида определили его, как аналог ПТГрП, представляющий собой мощный селективный активатор сигнального пути рецептора PTH1R. (Dong J. et al., 2001; Hattersley G. et al., 2016; Varela A. et al., 2017a). Растущий интерес к абалопаратиду основывается на результатах некоторых исследований на животных и людях, которые показали, что этот синтетический пептид обладает мощной и быстрой анаболической активностью с уменьшенным эффектом резорбции костной ткани по сравнению с терипаратидом и улучшенными характеристиками стабильности (Hattersley G. et al., 2016; Doyle N. et al., 2013; Xu J. et al., 2013). В клеточной линии человеческих остеобластов абалопаратид и терипаратид увеличили экспрессию факторов связанных с формированием и резорбцией костной ткани (RANKL и М-CS мРНК), но эти эффекты были быстро устранены после удаления абалопаратида из культуральной среды, в то время как в клетках обработанных терипаратидом они были более длительными (Makino A. et al., 2015).
Для абалопаратида, как и для любого остеоанаболического агента, доказательства значимой связи между изменением МПКТ и снижением риска разрушения кости основаны на установлении четкой, последовательной и благоприятной взаимосвязи между массой кости и ее структурной прочностью. Неклиническая оценка прочности кости и качества костной ткани может предоставить важные данные о влиянии исследуемых веществ на состояние костной ткани. Исследования на животных позволяют провести тестирование прочности кости на клинически значимых участках, таких как длинные кости, шейка бедренной кости и позвонки, а также возможность оценки ex vivo массы, плотности и геометрии образцов кости до биомеханического тестирования. Эти особенности устраняют определенные ограничения клинической денситометрии, такие как артефакт движения и интерференция мягких тканей. Доклинические исследования, проведенные на животных, показали заметную остеотропную анаболическую активность абалопаратида у овариэктомированных крыс получавших препарат после развития остеопении. Цель этих исследований состояла в определении долгосрочных эффектов воздействия абалопаратида на массу костной ткани, как кортикальной так и губчатой кости, которые оценивали по показателю МПКТ, определяемой периферической количественной компьютерной томографией и прочности кости, определяемой путем биомеханического тестирования. Механизмы, с помощью которых абалопаратид влияет на кости исследовали путем оценки биомаркеров ремоделирования кости и гистоморфометрических показателей метаболизма костной ткани. Данные, полученные в исследовании на крысах показали дозозависимое увеличение МПКТ после введения абалопаратида, увеличение маркеров формирования костей, но не маркеров ее резорбции, а также увеличение прочности кости (Xu J. et al., 2013). В исследовании на животных (Bahar H. et al., 2016) с моделированием остеопороза оценивали влияние 6-недельного ежедневного введения абалопаратида на кость у взрослых крыс. Общая МПКТ была измерена методом двойной рентгеновской абсорбциометрии invivo в конце 8-недельного периода после овариэктомии. Эти данные верифицировали развитие остеопении всей бедренной кости, диафиза бедренной кости и поясничного позвонка. Оценку трабекулярной архитектуры в поясничном позвонке (L4) и метафазе дистального отдела бедренной кости и геометрии кортикальной кости проводили с использованием микрокомпьютерной томографии при использовании модели ex vivo. Были также оценены морфометрические параметры, включая объемную долю кости, объем кости, трабекулярное число, толщина трабекулы, трабекулярный интервал, плотность связи и плотность кости, площадь и толщина кортикальной кости. Зафиксированные измененния МПКТ в области позвоночника и бедренной кости, по всей видимости, опосредованы главным образом увеличением объема трабекулярной и кортикальной кости. Улучшения в кортикальной кости были очевидны по показателям увеличенной МПКТ в середине диафиза бедренной кости, а также по данным микрокомпьютерной томографии свидетельствующих об увеличении объема и толщины кортикальной кости. Индуцированные абалопаратидом лучшения в губчатой кости были выявлены в результате оценки состояния костной ткани в позвонке (L4) и дистального отдела метафиза бедренной кости, которая продемонстрировала увеличение объема губчатой кости и ее МПКТ, а также улучшение трабекулярной микроархитектуры. Позвонки были протестированы в деструктивном биомеханическом испытании на сжатие. Полученные результаты, впервые описывают действие абалопаратида на прочность кости, указывают на то, что лечение экспериментально смоделированной остеопении с помощью абалопаратида полностью восстановило вызванную потерю костной ткани и увеличивало прочность кости на поясничном отделе позвоночника, диафизе бедра и шейке бедра крыс. Оценка прочности кости была проведена на участках скелета, которые соответствуют областям с повышенным риском переломов у женщин в постменопаузе. Биомеханическия оценка кости показала существенное улучшение ее структурной прочности у животных, получавших абалопаратид. Параметры костной массы и прочности у животных с экспериментальным остеопорозом, получавших инъекции абалопаратида превышали таковые у контрольных животных с неудаленными яичниками, что еще больше подчеркивает мощный анаболический потенциал этого аналога ПТГрП. Авторы исследования заключили, что увеличение прочности костных структур под влиянием абалопаратида в значительной степени зависит от увеличения плотности и объема костной массы.
В другом экспериментальном исследовании, проведенном на крысах с остеопенией, индуцированной удалением яичников изучали механизмы, с помощью которых абалопаратид увеличивает костную массу. Животные получали ежедневные подкожные инъекции препарата на протяжении 12 месяцев. По данным денситометрических, биохимических и гистоморфометрических исследований установлено, что на фоне введения абалопаратида увеличились биохимические маркеры формирования костной ткани без увеличения маркеров резорбции кости и без гиперкальциемии. Абалопаратид увеличил гистоморфометрические показатели формирования кости на трабекулярной, эндокортикальной и периостальной поверхностях без увеличения остеокластогенеза, индуцировал значительное увеличение трабекулярного объема костной ткани, ее плотности и улучшения в трабекулярной микроархитектуры. Абалопаратид стимулировал периостальное увеличение кости и увеличению объема кортикальной костной ткани большеберцовой кости. МПКТ у крыс с остеопенией увеличилась на 25 % после 12 месяцев введения абалопаратида. Полученные данные позволили предположить, что зафиксированные измененияв кортикальной и губчатой костной ткани связаны с селективными анаболическими эффектами абалопаратида, при отсутствии одновременной активации резорбции кости (Varela A. et al., 2017a). В этой же лаборатории исследовали влияние 12-месячного введения абалопаратида на массу, прочность и качество костной ткани у остеопенических овариэктомированных крыс (Varela A. et al., 2017b). Эффекты широкого (25-кратного) диапазона доз абалопаратида оценивались по структурным биомеханическим свойствам поясничного позвонка, диафиза бедренной кости и шейки бедра в сочетании с оценками костной массы, плотности и геометрии ex vivo. Качество костной ткани оценивали путем оценки взаимосвязи между массой кости и ее структурной прочностью. Денситометрия костей и периферическая количественная компьютерная томография были проведены in vivo до операции, в конце периода развития остеопении и через 3, 6 и 12 месяцев введения абалопаратида. Денситометрия in vivo показала заметный прирост костной массы у животных получавших абалопаратид в трабекулярных и корковых участках, включая устойчивое увеличение МПКТ по всему скелету. Увеличение объема кортикальной кости большеберцового диафиза было обусловлено увеличением костной массы на надкостничной и эндокортеральной поверхностях. В соответствии с приростом массы и объема трабекулярной и кортикальной кости, введение абалопаратида обусловило дозозависимое повышение прочности костной ткани в поясничном позвонке, бедренном диафизе и шейке бедра. Это исследование показало, что длительное ежедневное введение абалопаратида крысам с экспериментальной остеопенией дозозависимо увеличивает костную массу и прочность в поясничном отделе позвоночника, голени и бедренной кости. Это увеличение дополнительно сопровождалось улучшенной геометрией кортикального компартмента костной ткани, повышенной структурной прочностью кости и сохранением или улучшением ее изученных свойств. Результаты исследования на овариэктомированных обезьянах, которым после окончания периода развития остеопении ежедневно вводили абалопаратид также позволили зафиксировать заметный анаболический эффект. Отмечен значительный прирост МПКТ, а также увеличение прочности кости и маркеров формирования костной ткани. Введение абалопаратида привело к полному восстановлению индуцированной овариэктомией потери прочности тела позвонков, шейки бедренной кости, увеличению МПКТ метафиза большеберцовой кости. Это исследование показало, что абалопаратид способствует быстрому формированию качественно новой костной ткани у обезьян с остеопенией, а также улучшение прочности костей в клинически значимых участках (Doyle N. et al., 2013).
Эти наблюдения изменения костной массы под влиянием абалопаратида у крыс с экспериментальной остеопенией согласуются с данными продемонстрировавшими увеличение МПКТ зафиксироваными в фазе 2 клинических испытаний лечебных эффектов абалопаратида у женщин с постменопаузальным остеопорозом (Leder B.Z. et al., 2015). Препарат прошел в 2014 году фазу III рандомизированных, двойных слепых плацебо и компаратор контролируемых клинических испытаний в рамках международного многоцентрового исследования в 28 медицинских центрах США, Великобритании, Индии, Аргентины (Miller P.D. et al., 2016; Miller P.D. et al., 2015).
В 2015 году на заседаниях Эндокринологического общества (Сан-Диего, Калифорния, 5–8 марта) и Американского общества минеральных исследований (Сиэтл, штат Вашингтон, 9–12 октября) были представлены предварительные результаты исследования ACTIVE (Abaloparatide Comparator In Vertebral Endpoints) в рамках которого исследовали эффекты 18-месячного введения абалопаратида на показатели МПКТ, возникновение новых переломов тел позвонков, а также внепозвоночных переломов у женщин с остеопорозом в постменопаузе в сравнении с этими же показателями у женщин получавших терипаратид (Gonnelli S., Caffarelli C., 2016). Исследование ACTIVE было рандомизированным, двойным слепым, плацебо-контролируемым, сравнительным, многоцентровым, 18-месячным международным исследованием у 2463 женщин в постменопаузе с остеопорозом, предназначенным для оценки эффективности и безопасности подкожного введения абалопаратида в дозе 80 мкг для снижения риска переломов позвонков и внепозвоночных переломов. Женщины в возрасте от 49 до 86 лет были включены в исследование ACTIVE, если у них были рентгенологические доказательства по меньшей мере 1 или 2 умеренных переломов поясничных или грудных позвонков или переломов позвоночника в анамнезе в течение предыдущих 5 лет, в дополнение к Т-баллу МПКТ –2,5 на поясничном отделе позвоночника или бедренной кости. Женщины старше 65 лет также были зарегистрированы без наличия перелома в анамнезе, если у них был Т-балл МПКТ –3,0. МПКТ измеряли на протяжении трубчатой части бедренной кости, в шейке бедра и в поясничном отделе позвоночника в начале, 6-го, 12-го и 18-го месяцев исследования. Новые костные переломы бедренной кости, в шейке бедра и в поясничном отделе позвоночника позвонков были оценены и подтверждены путем анализа медицинских и рентгенографических записей (Cosman F. et al., 2017). Абалопаратид уменьшал возникновение новых переломов позвонков на 86 % по сравнению с плацебо (p < 0,001) и невертебральные переломы на 43 % (p = 0,049) у женщин в постменопаузе с остеопорозом. Подкожное введение абалопаратида увеличило минеральную плотность костной ткани на 3,4 % на протяжении бедренной кости, на 2,9 % в шейке бедренной кости и на 9,2 % в поясничном отделе позвоночника через 18 месяцев (все p < 0,001 против плацебо). Представленный здесь анализ был рассчитан на то, чтобы оценить, были ли сокращения риска переломов и увеличения МПКТ согласованными на разных уровнях базового риска. У исследуемых получавших абалопаратид зафиксированы наибольшее снижение частоты возникновения новых переломов позвоночника и внепозвоночных переломов по сравнению с пациентами получавших терипаратид, либо получавших плацебо. (Cosman, F. et al., 2017). В конце 18-месячного периода исследования у пациентов, получавших либо абалопаратид либо терипаратид отмечен рост МПКТ в поясничном отделе позвоночника. У пациентов, получавших абалопаратид, зафиксировано значительно большее увеличение МПКТ в бедренной кости, в дистальной части лучевой кости и в шейке бедра по сравнению с группой получавшей терипаратид (Leder B.Z. et al., 2015; Miller P.D. et al., 2015; Cosman F. et al., 2017). Не было выявлено никаких клинически значимых взаимодействий между любыми базовыми факторами риска и эффектом лечения абалопаратидом на новые морфометрические переломы позвонков, невертебральные переломы или увеличение МПКТ. Абалопаратид обеспечивает защиту от переломов последовательно в самых разных возрастных и базовых рисках, в том числе с и без предшествующих переломов, и он потенциально полезен для широкой группы женщин в постменопаузе с остеопорозом. Результаты проведенных исследований подтверждают, что абалопаратид может стать эффективным анаболическим средством для терапии остеопороза (Cosman F., 2015).
Результаты ACTIVE были опубликованы в Журнале Американской медицинской ассоциации в августе 2016 года (Miller P.D. et al., 2016). Продолжением изучения эффективности препарата в исследовании ACTIVE стало исследование ACTIVExtend с участием зарегистрированных в исследовании ACTIVE пациентов, которые после завершения 18-месячного периода подкожного введения инъекций абалопаратида или плацебо больше не получали инъекций абалопаратида или плацебо, но поддерживались в их оригинальных рандомизированнх группах лечения и получали алендронат 70 мг перорально один раз в неделю, с добавками кальция и витамина D в течение 6 месяцев (Cosman F. et al., 2017). Это исследование включало 558 пациентов, которые ранее получали абалопаратид и 581 пациентов, которые ранее получали плацебо. Совокупный 25-месячный период исследования эффективности включал 18 месяцев воздействия абалопаратида или плацебо, 1 месяц без лечения, а затем 6 месяцев терапии алендронатом. Частота новых переломов позвонков в течение 25 месяцев составила 0,6 % у пациентов, получавших абалопаратид. Относительное снижение риска новых переломов позвонков за 25 месяцев составило 87 % и невертебральных переломов 52 % у пациентов, получавших абалопаратид, а затем алендронат по сравнению с исследуемыми получавших последовательно плацебо, а затем алендронат в течение 6 месяцев Увеличение МПКТ у исследуемых получавших последовательно абалопаратид и алендронат составляло 12,8 %; 5,5 % и 4,5 % для поясничного отдела позвоночника, шейки бедра и тела бедренной кости соответственно. Использование алендроната после подкожных инъекций абалопаратида в исследовании ACTIVExtend обеспечило официальную оценку реального терапевтического сценария для пациентов с постменопаузальным остеопорозом. Пациентам обычно показано антирезорбтивное лечение после анаболической терапии для сохранения остеоанаболических преимуществ. Данные о том, что в течение 6 месяцев лечения алендронатом в группе, которая первоначально была рандомизирована для приема абалопаратида подкожно, было значительно меньше позвоночных и невертебральных переломов, свидетельствуют о постоянном эффекте абалопаратида на улучшение прочности кости. Результаты этого исследования поддерживают раннюю анаболическую терапию в качестве потенциального варианта лечения для женщин в постменопаузе с остеопорозом поскольку большинство пациентов с предыдущими переломами или очень низкой МПКТ имеют структурные и количественные нарушения целостности скелета (Genant H.K. et al., 1996; Bell K.L. et al., 1999; Rosen C.J. et al., 2013). Кроме того, последовательность анаболической терапии, сопровождаемая антирезорбтивной терапией, может иметь наибольшую вероятность достижения увеличения МПКТ и достижения цели предотвращения переломов. По результатм исследования ACTIVExtend был сделан вывод, что последовательное применение подкожного введения абалопаратида и еженедельного перорального приема алендроната улучшает показатели МПКТ и уменьшает риск скелетных переломов и является высокоэффективным вариантом лечения для женщин в постменопаузе, подверженных риску возникновения переломов, связанных с остеопорозом. Результаты первых шести месяцев ACTIVExtend были опубликованы в начале 2017 года (Chew C.K., Clarke B.L., 2017; Cosman F. et al., 2017). Абалопаратид был представлен на рассмотрение в Управлении по контролю за продуктами и лекарствами США (FDA) (Chew C.K., Clarke B.L., 2017) и был впервые утвержден 28 апреля 2017 года FDA под брендом «Tymlos» для лечения женщин с остеопорозом в постменопаузе, с высоким риском развития травм, имеющим в анамнезе остеопоротический перелом, множественные факторы риска перелома или для пациентов, лечение остеопороза у которых было неэффективным при использовании других доступных средств. Это первый случай за предшествующие 15 лет, когда было одобрено анаболическое средство для лечения женщин с остеопорозом. Абалопаратид производится «Radius Health Inc.» (Nasdaq: RDUS), биомедицинской компанией, базирующейся в Уолтхеме, штат Массачусетс. Эта компания сосредоточена на разработке новых терапевтических средств для лечения остеопороза, рака и эндокринных заболеваний. Утвержденние FDA «Tymlos» было основано на результатах 18-месячного клинического исследования ACTIVE и первых шести месяцев исследования ACTIVExtend. Субъекты были рандомизированы для приема TYMLOS 80 мкг или плацебо, назначаемого подкожно один раз в день. Данные продемонстрировали значительное последовательное увеличение минеральной плотности костной ткании быстрое снижение риска переломов позвонков и внепозвоночных переломов вне зависимости от возраста, расы, этнической принадлежности, географического региона, длительности периода послтменопаузы, наличия или отсутствия предшествующего перелома (позвоночного или внепозвоночного) и минеральной плотности кости в начале исследования. В частности, в исследовании ACTIVE TYMLOS продемонстрировал значительное снижение относительного риска новых переломов по сравнению с плацебо: 86 % при новых переломах позвонков и 43 % при внепозвоночных переломах. Абсолютное снижение риска составило 3,6 % и 2,0 % соответственно. Компания «Radius Helth» сообщила на недавно прошедшей в США конференции в рамках «ENDO 2018» (ежегодная серия встреч эндокринологов под эгидой Американского эндокринологического общества) подробности о проведенных испытаниях абалопаратида. По сведениям представителей фармкомпании, лечение препаратом с последующим применением алендроната (подавляет костную резорбцию) привело к большему увеличению минеральной плотности костной ткани у женщин с остеопорозом по сравнению с пациентами, которые получали плацебо, а затем алендронат. В США новое лекарство от остеопороза встретили с большим энтузиазмом. Абалопаратид показал большую безопасность применения, чем использовавшийся ранее терипаратид (он в два раза чаше вызывает гиперкальциемию).
По рыночным прогнозам аналитиков, североамериканские производители фармпрепаратов для лечения остеопороза в ближайшие годы будут доминировать в этой отрасли (в том числе благодаря появлению абалопаратида). TYMLOS по сути стал новым компонентом доминирующий в настоящее время на мировом рынке линейки препаратов для лечения остеопороза, в которой основные позиции занимают препараты Форстео, производимым американской фармацевтической корпорацией «Eli Lilli» и Пролиа (Деносумаб) производства транснациональной биофармацевтической компании «Amgen», объем продаж которых в 2016 году составил 1,5 млрд. и 1,64 млрд долларов США соответственно. В июле 2017 года Radius Health лицензировала права Teijin Limited для производства и коммерциализации абалопаратида для подкожного введения в Японии. Teijin Limited по соглашению с Ipsen Pharma SAS проводит клиническое исследование фазы III у японских пациентов с остеопорозом. «Radius Health Inc.» в продолжение линии абалопаратида для подкожного введения (Abaloparatide SC) разрабатывает также трансдермальную композицию абалопаратида (Abaloparatide-TD) в виде удобного, трансдермального пластыря (Abaloparatide-TD) (Saeh J. et al., 2016). В недавно проведенной рандомизированной, двойной слепой, плацебо-контролируемой фазе 2 клинических испытаний в девяти центрах в Соединенных Штатах, Дании, Польши и Эстонии исследовали клиническую эффективность и безопасность Abaloparatide-TD. Оценивали изменения МПКТ по сравнению с трансдермальным плацебо и Abaloparatide-SC. У женщин в возрасте от 55 до 85 (включительно) у которых была МПКТ-баллов –2,5 в поясничном отделе позвоночника или бедра (шейки бедра). Abaloparatide-TD вводили с помощью подпружиненного аппликатора, а Abaloparatide-SC вводили с помощью многофункционального пера инжектора, в который был вставлен стеклянный картридж с мультидозой. За четыре недели до начала лечения, пациенты начали принимать препараты кальция и витамина D, которые продолжались на протяжении всего исследования. Исследуемый препарат вводился один раз в день в течение в общей сложности шести месяцев. Abaloparatide-TD продемонстрировал статистически значимое увеличение среднего процента МПКТ по сравнению с плацебо в поясничном отделе позвоночника и в тазобедренном суставе. Эти результаты показали четкое доказательство достижения зависимого от дозы увеличения МПКТ. После дополнительной работы разработчики намерены продвигать оптимизированный Abaloparatide-TD в дополнительных клинических исследованиях 3 фазы и затем представить его на утверждение. Утверждается, что дальнейшее исследование других аналогов ПТГрП является перспективным и целесообразным, поскольку у них есть потенциал, чтобы выступать в качестве альтернативных анаболических скелетных факторов, которые могли бы быть полезными для решения некоторых проблем современной медицины (Augustine M., Horwitz M.J., 2013; Martin T.J., 2016).
Экспериментальные исследования остеотропных эффектов абалопаратида интенсивно продолжаются и после его утверждения в качестве фармпрепарата для лечения остеопороза у женщин в постменопаузе. Проведена оценка влияния 16-месячного введения абалопаратида на формирование, резорбцию, плотность и прочность костей у 65 взрослых овариэктомированных обезьян Cynomolgus (cynos) (Doyle N. et al., 2018). Результаты исследования продемонстрировали, что абалопаратид увеличивает у остеопенических обезьян костную массу всего тела, поясничного отдела позвоночника, диафиза большеберцовой кости, шейки бедра и вертела бедренной кости. Введение абалопаратида было связано с большей прочностью поясничного отдела позвоночника и не оказывало неблагоприятного влияния на соотношение массы и прочности костей для позвонков, шейки бедра, диафиза бедра или лучевой кости предплечья.
Одним из возможных направлений клинического использования фармакотерапевтических свойств абалопаратида является его применение для лечения остеопороза у мужчин (Cosman F. et al., 2017). Besschetnova T. et al. (2019) исследовали влияние абалопаратида на формирование кости, костную массу и прочность костей у самцов андроген-дефицитных крыс с орхиэктомией (модель остеопороза у самцов). Четырехмесячным крысам Sprague-Dawley сделали операцию орхиэктомии или фиктивную операцию. Восемь недель спустя крысам с ложной операцией вводили носитель (физиологический раствор), а крысам с орхиэктомией вводили носитель или абалопаратид в дозе 5 или 25 мкг/кг путем ежедневной подкожной инъекции в течение 8 недель. Динамическая гистоморфометрия кости показала, что диафиз большеберцовой кости обеих подопытных групп животных, получавших абалопаратид, имел более высокую периостальную минерализующую поверхность, скорость внутрикортикального формирования кости (BFR), эндокортикальный BFR и корковую толщина против контроля. Позвоночный трабекулярный BFR был также выше в обеих группах, получавших абалопаратид, по сравнению с контролем, а группа, получавшая абалопаратид в дозе 5 или 25 мкг/кг имела более высокую поверхностьтрабекулярного остеобласта без увеличенной поверхности остеокластов. По данным микро-КТ, в позвонке и дистальной части бедренной кости обеих групп, получавших абалопаратид, улучшились объем и микро-архитектура трабекулярной кости, а также диафизы бедренной кости группы получавшей абалопаратид в дозе 25 мкг/кг имели большую толщину кортикальную без увеличения пористости против контроля. Биомеханическое тестирование показало, что обе группы животных, получавших абалопаратид имели более сильные позвонки и шейки бедренной кости по сравненю с контрольной группой крыс. Эти данные обеспечивают доклиническую поддержку для оценки абалопаратида в качестве потенциального метода лечения остеопороза у мужчин.
Предполагается, что абалопаратид может увеличивать МПК и прочность костей у животных и, возможно, у пациентов с глюкокортикоид-индуцированной потерей костной массы. В недавних публикациях (Chandler H. et al., 2019a; 2019b) представлены результаты исследования влияния терапии абалопаратидом на массу и прочность кости у взрослых овариэктомированных кроликов с остеопенией, вызванной глюкокортикоидами. У подопытных животных наблюдался значительный дефицит трабекулярной и кортикальной костной массы, что приводило к снижению прочности позвоночника и бедренной кости. Двенадцать недель терапии абалопаратидом привели к увеличению объема и плотности губчатой кости и улучшению трабекулярной микроархитектуры, а также увеличению объема и плотности кортикальной кости и улучшению прочности на изгиб бедренного диафиза. Эти результаты исследования абалопаратида свидетельствуют о потенциальной возможности его терапевтического применения для улучшения МПК и прочности кости в условиях, когда глюкокортикоиды вызывают значительную потерю костной массы и повышенный риск переломов.
Поиск новых возможных направлений терапевтическикого применения абалопаратида все более широко исследуется для решения ряда проблем современной медицины. Абалопаратид, разработанный, как аналог N-концевого домена ПТГрП, с высокой степенью вероятности может обладать свойствами его нативного домена и, в том числе, хондротропными эффектами. Недавно было сообщено, о проведении исследования влияния абалопаратида на дегенерацию поясничного диска в рамках которого исследователи проводят рандомизированное, двойное слепое, плацебо-контролируемое клиническое испытание фазы 2 эффекта абалопаратида для лечения дегенеративного заболевания поясничного диска (ClinicalTrials.gov Идентификатор: NCT03708926). В декабре 2019 года началась фаза I пилотного исследования применения абалопаратида в сочетании с бевацизумабом при миелодиспластических синдромах (ClinicalTrials.gov Идентификатор: NCT03746041). Запланировано проведение с декабря 2018 по сентябрь 2021 года проспективного рандомизированного, двойного слепого, плацебо-контролируемого 12-месячный пилотного исследования фаза 2 для изучения эффективности абалопаратида у женщин в постменопаузе, нуждающихся в хирургии поясничного отдела позвоночника и получающих первичную хирургию спондилодеза (ClinicalTrials.gov Идентификатор: NCT03841058).