
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ПАРАТГОРМОН-РОДСТВЕННЫЙ ПРОТЕИН. 2-е издание переработанное и дополненное
Курзанов А. Н., Ледванов М. Ю., Быков И. М., Медведев В. Л., Стрыгина Е. А., Бизенкова М. Н., Заболотских Н. В., Ковалев Д. В., Стукова Н. Ю.,
10.5.1. Паратгормон-родственный протеин и лептин
Липофибробласты развивающегося крысиного легкого продуцируют цитокин лептин, который стимулирует дифференцировку эпителиальных клеток альвеолярного типа II. Лептин продуцируется развивающимся легким крыс, начиная с E17-E18, увеличиваясь в 7–10 раз на E20. Лептин также секретируется фетальными фибробластами легких человека. Рецептор лептина экспрессируется клетками легкого типа II плода крысы и эпителиальными клетками человека. Экспрессия лептина мезенхимными клетками и его рецептора эпителиальными клетками развивающейся альвеолы образуют паракринный сигнальный контур, о чем свидетельствуют экспериментальные данные Torday J.S. et al. (2002), которые свидетельствуют, что, секреция лептина липофибробластоми легких плода стимулируется ПТГрП, лептин стимулирует de novo синтез сурфактанта эпителиальными клетками легкого типа II, который блокируется антителом лептина, антагонист рецептора ПТГрП блокирует экспрессию мРНК лептина эксплантами, но не ингибирует стимуляцию экспрессии фосфолипида или белка поверхностно-активного вещества, что указывает на то, что фибробласто-зависимая стимуляция ПТГрП созревания клеток II типа требует экспрессии лептина липофибробластами. Стимулированная ПТГрП экспрессия лептина липофибробластами обеспечивает закрытую паракринную петлю от клетки типа II к липофибробласту и обратно к клетке типа II, опосредованную эндогенно продуцируемыми факторами роста как эпителиального, так и мезенхимального происхождения, взаимодействующих совместно, чтобы индуцировать развитие альвеолярного ацинарного легкого (Torday J.S., 2002). ПТГрП участвует в регуляции пролиферации альвеолярных клеток типа II, дифференцировки, апоптоза и образования поверхностно-активных веществ (Rubin L.P. et al., 2009). Альвеолярные клетки типа II высвобождают ПТГрП, который действует на липофибробласты посредством активации рецептора PTH1R. Это приводит к индукции белка, ассоциированного с дифференциацией жировой ткани (ADRP) и рецептора активатора пролиферации пероксисом (PPAR– γ), в липофибробластах. Оба фактора улучшают поглощение липидов, образование поверхностно-активных веществ и ослабляют трансдифференцировку липофибробластов в миофибробласты (Torday J.S., Rehan V.K., 2007). Кроме того, липофибробласты продуцируют лептин, который действует как модулятор положительной обратной связи на экспрессию белков поверхностно-активных веществ альвеолярными клетками II типа. Паракринное взаимодействие между альвеолярными клетками и липофибробластами типа II вызывает ПТГрП-индуцированные эффекты. ПТГрП был идентифицирован как основной фактор в производстве поверхностно-активных веществ через паракринный путь, включающий лептин (Torday J.S., Rehan V.K., 2007), который участвует в ПТГрП-зависимой регуляции поверхностно-активных веществ (рис. 15).
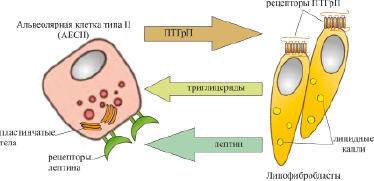
Рис. 15. ПТГрП-индуцированное взаимодействие между альвеолярными эпителиальными клетками типа II (AEC II) и липофибробластами
в продукции поверхностно-активных веществ
Липофибробласты выделяют триглицериды и лептин, которые необходимы для производства сурфактанта. Трансдифференцировка липофибробластов в миофибробласты является основной проблемой при заболеваниях легких (Torday J.S., Rehan V.K., 2007). Активация рецептора PTH1R ослабляет пролиферацию и дифференцировку альвеолярных клеток типа II. ПТГрП является ключевым фактором в ремоделировании легких, препятствуя трансдифференцировке липофибробластов в миофибробласты и поддерживая образование поверхностно-активных веществ и регулируется лептином. Тем не менее, неизвестно, как модифицировать легочную экспрессию ПТГрП. Oruqaj L. et al. (2018) исследовали роль лептина в регуляции экспрессии ПТГрП в легких. В экспериментах использовали лептин-дефицитных мышей. Авторы предположили, что диета с высоким содержанием жира (HFD) может улучшить ремоделирование легких. Первым важным результатом проведенного исследования является то, что HFD увеличивает экспрессию мРНК ПТГрП в легких in vivo. Этот эффект связан с повышенными уровнями лептина в плазме, потому что HFD повышала уровни лептина в плазме, а у лептин-дефицитных мышей, выявлено снижение экспрессии мРНК ПТГрП легких. Другой вывод цитируемого исследования заключается в том, что внелегочный лептин, который может быть обнаружен при HFD, может изменять экспрессию ПТГрП легких. ПТГрП действует паракринным способом на альвеолярные интерстициальные липофибробласты и индуцирует экспрессию рецепторов PTH1R, ADRP и PPAR γ. В совокупности эти данные впервые показали, что уровни лептина в плазме влияют на легочную экспрессию ПТГрП. Ранее этот эффект связывали с паракринным действием лептина из эпителиальных клеток. Выяснилось соотношение между, концентрациями лептина в плазме и роль лептина в качестве паракринного фактора задействованного в функциионировании легких, дифференцировке и роль легочного перекрестного взаимодействия ПТГрП и лептина. ПТГрП является одним из основных факторов в легких, который регулирует эпителиально-мезенхимальные паракринные перекрестные взаимовлияния. Он является основным регулятором образования сурфактанта (Torday J.S., Rehan V.K., 2007). Эпителиальные клетки формируют положительную обратную связь с альвеолярными клетками II типа путем продукции лептина (Torday J.S., Rehan V.K., 2002). В этом физиологическом механизме обратной связи ПТГрП индуцирует высвобождение лептина из эпителиальных клеток, что является триггером экспрессии и высвобождения ПТГрП (Torday J.S. et al., 2002). Высокая активация ПТГрП-эпителиальномезенхимального паракринного перекрестного взаимодействия считается защитным механизмом, который обеспечивает лучшую оксигенацию крови в легких (Stern J.-B., 2002; Torday J.S., Rehan V.K., 2007). Известно несколько механизмов, которыми ПТГрП стабилизирует функцию легких. Это сосудорасширяющий эффект, улучшающий перфузию, влияние на образование поверхностно-активных веществ и его ингибирующее действие на трансдифференцировку липофибробластов в миофибробласты (Hastings R.H., 2004; Torday J.S., Rehan V.K., 2007). ПТГрП стимулирует дифференцировку адепителиальных интерстициальных фибробластов в липофибробласты, продуцирующие лептин (Torday J.S. and Rehan V.K., 2002). Лептин, в свою очередь, стимулирует продуцирование поверхностно-активного вещества клетками типа II. Продуцирование ПТГрП клеткой альвеолярного типа II, стимулирует как липофибробластовую продукцию лептина, так и альвеолярную капиллярную перфузию. Это приводит к эффективному альвеолярному газообмену при адаптации к метаболическим потребностям организма, определяемому растяжением альвеолярной стенки, координирующим стимулирование ПТГрП и секреции лептина и экспрессию их рецепторов клеточной поверхности на липофибробласте и клетке II типа соответственно. Эти клеточно-опосредованные взаимодействия между ПТГрП и лептином координируют «по требованию» продукцию сурфактанта (Torday J.S. and Rehan V.K., 2002) с альвеолярной капиллярной перфузией (Gao и Raj 2005), что является функциональной основой легочной ткани. Комбинированные эффекты ПТГрП и лептина на поверхностно-активное вещество и кровоток приводят к согласованию вентиляции и перфузии и таким образом участвуют в формировании физиологического механизма альвеолярного гомеостаза.