
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
Лабораторная работа. ОПРЕДЕЛЕНИЕ КОНСТАНТЫ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ
Теоретическая часть
Скорость любой сложной (многостадийной) реакции равна скорости наиболее медленной стадии, которая называется лимитирующей стадией реакции.
Например, если превращение вещества А в вещество F осуществляется через последовательные стадии, протекающие со скоростями v1, v2, v3, v4, v5
v1 > v2 > v3 < v4 < v5
А  B
B  C
C  D
D  E
E  F,
F,
то скорость результирующей реакции
А  F
F
будет равна v3.
Химическая реакция
2Na2S2O3 + 2KI + 2HCl + H2O2 = Na2S4O6 + 2KCl + 2NaI + 2H2O
тиосульфат тетратионат
натрия натрия
протекает в две стадии:
I) 2KI + 2HCl + H2O2 = I2 + 2KCl + 2H2O.
II) 2Na2S2O3 + I2 = Na2S4O6 + 2NaI.
Причём, лимитирующей является стадия I), скорость которой, в свою очередь, не зависит от изменения концентрации HCl, взятой в избытке. Таким образом, скорость v рассматриваемого процесса в указанных условиях определяется только величинами [KI] и [H2O2], а также константой скорости химической реакции (k):
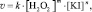 (1)
(1)
где m, n – порядки реакции по H2O2 и по KI соответственно, вычислив которые можно определить искомую величину k:
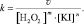 (2)
(2)
Значение v уравнения (2) определяется по формуле:
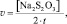 (3)
(3)
где t – экспериментально определяемое время между началом реакции и полным расходом тиосульфата натрия, определяемым по окрашиванию раствора выделяющимся йодом (см. таблицу экспериментальной части).
Для вычисления порядков реакции m и n можно использовать два способа: аналитический и графический.
Аналитический способ вычисления порядка реакции по перекиси водорода
Экспериментально определяют скорости реакции для различных [H2O2], но постоянной [KI]. При таких условиях уравнение (1) может быть преобразовано следующим образом:
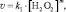 (4)
(4)
где kI = k∙[KI]n, или:
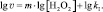 (5)
(5)
Для двух скоростей реакции v1 и v2, определённых для различных [H2O2]1 и [H2O2]2 соответственно, справедлива система двух уравнений с двумя неизвестными m и lg kI:
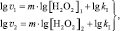 (6)
(6)
решение которой позволит вычислить порядок реакции по перекиси водорода (m):
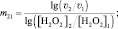 (7)
(7)
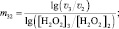 (8)
(8)
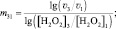 (9)
(9)
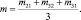 (10)
(10)
Графический способ вычисления порядка реакции по перекиси водорода
Равенство (5) представляет собой уравнение прямой, построенной в координатных осях lg[H2O2] и lgv, аналогичное уравнению прямой y = ax + b, построенной в координатных осях х и у. При этом m является тангенсом угла наклона этой прямой к оси lg[H2O2]. Таким образом, построив график зависимости lgv от lg[H2O2], можно вычислить порядок реакции по [H2O2], определяя тангенс угла наклона полученной прямой.
Аналитический способ вычисления порядка реакции по иодиду калия
Экспериментально определяют скорости реакции для различных [KI], но постоянной [H2O2]. При таких условиях уравнение (1) может быть преобразовано следующим образом:
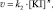 (11)
(11)
где k2 = k [H2O2]m, или:
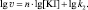 (12)
(12)
Для двух скоростей реакции v1 и v3, определённых для различных [KI]1 и [KI]2 соответственно, справедлива система двух уравнений с двумя неизвестными n и lg k2:
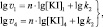 (13)
(13)
решение которой позволит вычислить порядок реакции по иодиду калия (n):
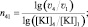 (14)
(14)
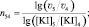 (15)
(15)
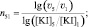 (16)
(16)
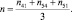 (17)
(17)
Графический способ вычисления порядка реакции по иодиду калия
Равенство (12) представляет собой уравнение прямой, построенной в координатных осях lg[KI] и lgv, аналогичное уравнению прямой y = ax + b, построенной в координатных осях х и у. При этом n является тангенсом угла наклона этой прямой к оси lg[KI]. Таким образом, построив график зависимости lgv от lg[KI], можно вычислить порядок реакции по [KI], определяя тангенс угла наклона полученной прямой.
Экспериментальная часть
Занесите в тетрадь таблицу, приведённую ниже.
I. Используя компьютерную программу chemlab, проделайте 5 виртуальных опытов, описанных ниже, и проведите соответствующие расчёты.
Опыт 1
1.1. Vп = 100 мл: 0,25 г Na2S2O3 + 20 мл H2O (до полного растворения);
1.2. Vп = 100 мл: 10,00 г KI + 20 мл H2O (до полного растворения);
1.3. Vп = 600 мл: (1.1.) + 1.2;
1.4. Vп = 600 мл: (1.3.) + 60 мл 1 М HCl;
1.5. Vп = 600 мл: (1.4.) + 50 мл 0,1 М H2O2 (Измерьте время (t, с) между моментом добавления H2O2 и моментом начала окрашивания раствора. Результат занесите в таблицу.)
1.6. Рассчитайте следующие величины:
V, n(Na2S2O3), [Na2S2O3], n(KI), [KI], lg [KI], n(H2O2), [H2O2], lg[H2O2], v, lgv
и занесите результаты в таблицу с точностью до второй цифры после запятой в нормализованной записи
Vмл =
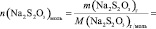
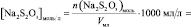
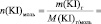
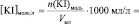
lg [KI] =
Поскольку при разбавлении растворов выполняется соотношение:
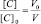 или
или 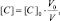
то в данном случае:
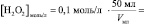
n(H2O2) = [H2O2]0∙V0 =
lg[H2O2] =
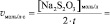
lgv =
Опыт 2
2.1. Vп = 100 мл: 0,25 г Na2S2O3 + 20 мл H2O (до полного растворения);
2.2. Vп = 100 мл: 20,00 г KI + 20 мл H2O (до полного растворения);
2.3. Vп = 600 мл: (2.1.) + (2.2.);
2.4. Vп = 600 мл: (2.3.) + 60 мл 1 М HCl + 150 мл H2O;
2.5. Vп = 600 мл: (2.4.) + 50 мл 0,1 М H2O2 (Измерьте время (t, с) между моментом добавления H2O2 и моментом начала окрашивания раствора. Результат занесите в таблицу.)
2.6. Рассчитайте следующие величины:
V, n(Na2S2O3), [Na2S2O3], n(KI), [KI], lg [KI], n(H2O2), [H2O2], lg[H2O2], v, lgv
и занесите результаты в таблицу с точностью до второй цифры после запятой в нормализованной записи
Vмл =
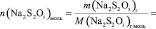
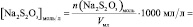
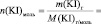
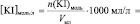
lg [KI] =
Поскольку при разбавлении растворов выполняется соотношение:
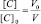 или
или 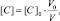
то в данном случае:
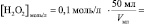
n(H2O2)=[H2O2]0∙V0 =
lg[H2O2] =
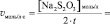
lgv =
Опыт 3
3.1. Vп = 100 мл: 0,25 г Na2S2O3 + 20 мл H2O (до полного растворения);
3.2. Vп = 100 мл: 40,00 г KI + 20 мл H2O (до полного растворения);
3.3. Vп = 600 мл: (3.1.) + (3.2.);
3.4. Vп = 600 мл: (3.3.) + 60 мл 1 М HCl + 450 мл H2O;
3.5. Vп = 600 мл: (3.4.) + 50 мл 0,1 М H2O2 (Измерьте время (t, с) между моментом добавления H2O2 и моментом начала окрашивания раствора. Результат занесите в таблицу.)
3.6. Рассчитайте следующие величины:
V, n(Na2S2O3), [Na2S2O3], n(KI), [KI], lg [KI], n(H2O2), [H2O2], lg[H2O2], v, lgv
и занесите результаты в таблицу с точностью до второй цифры после запятой в нормализованной записи
Vмл =
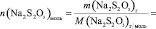
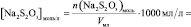

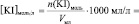
lg [KI] =
Поскольку при разбавлении растворов выполняется соотношение:
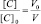 или
или 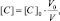
то в данном случае:
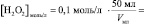
n(H2O2) = [H2O2]0∙V0 =
lg[H2O2] =
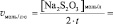
lgv =
Опыт 4
4.1. Vп = 100 мл: 0,25 г Na2S2O3 + 20 мл H2O (до полного растворения);
4.2. Vп = 100 мл: 10,00 г KI + 20 мл H2O (до полного растворения);
4.3. Vп = 600 мл: (4.1 + (4.2.);
4.4. Vп = 600 мл: (4.3.) + 60 мл 1 М HCl + 100 мл H2O;
4.5. Vп = 600 мл: (4.4.) + 100 мл 0,1 М H2O2 (Измерьте время (t, с) между моментом добавления H2O2 и моментом начала окрашивания раствора. Результат занесите в таблицу.)
4.6. Рассчитайте следующие величины:
V, n(Na2S2O3), [Na2S2O3], n(KI), [KI], lg [KI], n(H2O2), [H2O2], lg[H2O2], v, lgv
и занесите результаты в таблицу с точностью до второй цифры после запятой в нормализованной записи
Vмл =
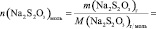
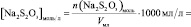
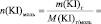
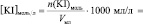
lg [KI] =
Поскольку при разбавлении растворов выполняется соотношение:
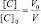 или
или 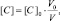
то в данном случае:
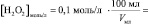
n(H2O2) = [H2O2]0∙V0 =
lg[H2O2] =
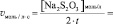
lgv =
Опыт 5
5.1. Vп = 100 мл: 0,25 г Na2S2O3 + 20 мл H2O (до полного растворения);
5.2. Vп = 100 мл: 10,00 г KI + 20 мл H2O (до полного растворения);
5.3. Vп = 600 мл: (5.1.) + (5.2.);
5.4. Vп = 600 мл: (5.3.) + 60 мл 1 М HCl + 300 мл H2O;
5.5. Vп = 600 мл: (5.4.) + 200 мл 0,1 М H2O2 (Измерьте время (t, с) между моментом добавления H2O2 и моментом начала окрашивания раствора. Результат занесите в таблицу.)
5.6. Рассчитайте следующие величины:
V, n(Na2S2O3), [Na2S2O3], n(KI), [KI], lg [KI], n(H2O2), [H2O2], lg[H2O2], v, lgv
и занесите результаты в таблицу с точностью до второй цифры после запятой в нормализованной записи
Vмл =
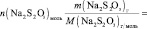
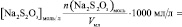
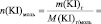
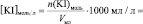
lg [KI] =
Поскольку при разбавлении растворов выполняется соотношение:
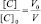 или
или 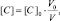
то в данном случае:
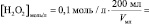
n(H2O2) = [H2O2]0∙V0 =
lg[H2O2] =
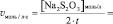
lgv =
II. В заполненной таблице выберите из пяти опытов три опыта с одинаковой концентрацией KI. Пользуясь данными этих трёх опытов, составьте три системы уравнений, аналогичных системе уравнений (6) теоретической части. Вычислите аналитическим способом три значения порядка реакции по H2O2 (m). Определите среднее значение m.
III. По данным таблицы постройте график зависимости lgv от lg[H2O2] в координатных осях, представленных на рис. 1
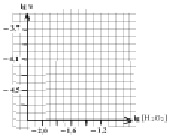
Рис. 1. Зависимость lgv от lg[H2O2] при [KI] = const =
позволяющая определить порядок реакции по H2O2: m = tg α =
Определите порядок реакции по H2O2 графическим способом.
IV. Сопоставьте среднее значение m, полученное аналитическим способом со значением m, полученным графическим способом.
V. В заполненной таблице выберите из пяти опытов три опыта с одинаковой концентрацией H2O2. Пользуясь данными этих трёх опытов, составьте три системы уравнений, аналогичных системе уравнений (6) теоретической части. Вычислите аналитическим способом три значения порядка реакции по KI (n). Определите среднее значение n.
VI. По данным таблицы постройте график зависимости lgv от lg[KI] в координатных осях, представленных на рис. 2

Рис. 2. Зависимость lgv от lg[KI] при [H2O2] = const =
позволяющая определить порядок реакции по KI: n = tg β =
Определите порядок реакции по H2O2 графическим способом.
VII. Сопоставьте среднее значение n, полученное аналитическим способом cо значением n, полученным графическим способом.
VIII. Пользуясь формулой (2) теоретической части, рассчитайте константу скорости рассматриваемой химической реакции для каждого опыта (k1; k2; k3; k4; k5) и определите среднее значение константы (k).
VIII. Ответьте на дополнительный вопрос: «Является ли рассмотренная реакция окислительно-восстановительной или нет?» и расставьте степени окисления при каждом атоме структурных формул веществ, приведённых ниже, дав этим веществам название.
IX. Выполните самостоятельную работу
[1] Например, свободный нейтрон может распадаться на протон, электрон и электронное антинейтрино. Протон, находящийся в составе ядра, может распадаться на нейтрон, позитрон и электронное антинейтрино.
[2]Под фазой движения в данном случае подразумевается значение производной dЕq /dl или dВ/dl, где l – отрезок пересечения электрического и магнитного полей.
[3] Амплитуда колебания – это модуль наибольшего отклонения от среднего значения колеблющейся величины.
[4]Знак «минус» означает, что сила направлена от пробной массы к источнику гравитационного поля, в то время как радиус-вектор  направлен в противоположную сторону.
направлен в противоположную сторону.
[5] В данном случае «минус»означает, что при расходовании этой энергии, работа будет совершаться против радиус-вектора, направленного от источника гравитационного поля к пробной массе.
[6]Ек = 3/2kT, где k = 1,38∙10–23 Дж/K – постоянная Больцмана.
[7] В дальнейшем будет называться просто «угол».
[8] Подробности о векторном произведении изложены в учебном пособии Шепель О.М., Заводенко Е.М. Математика и информатика – Томск: Издательский дом ТГУ, 2015, 236 с.
[9] То есть, может принимать как положительные, так и отрицательные значения.
[10] Замкнутыми называются системы, не обменивающиеся с окружающей средой ни энергией, ни веществом.
[11] Другая формулировка этого же закона гласит, что невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от тела менее нагретого к телу более нагретому.
[12] Под необратимостью процесса подразумевается его протекание преимущественно только в одну сторону.
[13] Обратимость процесса в данном случае означает его протекание в противоположных направлениях с одинаковой скоростью.
[14] Другая формулировка: при любом изотермическом процессе, проведённом при абсолютном нуле температуры, изменение энтропии равно нулю независимо от изменения любых параметров состояния (давление, объём и т. д.)
[15] Иногда такую протяжённость называют четырёхмерным континуумом.
[16]Поскольку масса является источником гравитационного поля, то она также рассматривается в качестве меры напряжённости (Е) создаваемого гравитационного поля на расстоянии r: 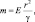 где γ – гравитационная постоянная. Хотя обе массы эквивалентны, но первая называется инертной, а вторая гравитационной.
где γ – гравитационная постоянная. Хотя обе массы эквивалентны, но первая называется инертной, а вторая гравитационной.
[17] Для постоянной Авогадро справедлива и другая размерность: 6,02·1023 а.е.м./г.
[18]В молекуле [NH4]Cl валентность азота равна трём, а ковалентность – четырём.
[19]05 Па ≈ 1 атм ≡ 760 мм рт. столба.
[20] То есть, за одну секунду концентрация кислорода уменьшится на 0,01 моль/л. В химии традиционно не придерживаются системы СИ – объёмы нередко измеряют в литрах, а массу в граммах.
[21] Значок (к.) означает кристаллическое агрегатное состояние вещества.
[22] Под радиацией подразумеваются излучения: положительно заряженных осколков ядер (α-излучение) отрицательно заряженных электронов (β-излучение), нейтронов, а также электромагнитных волн высокой частоты (γ-излучение)
[23] Строго говоря, столкновение трёх молекул не является одновременным. На первой стадии из двух частиц А и Б образуется промежуточная частица АБ, которая далее реагирует с молекулой С, образуя продукты реакции.
[24] Строение метана аналогично строению тетраэдра, рассмотренного в учебном пособии Шепель О.М., Чабовская Н.И. «Математика». – Томск: ЦНТИ, 2010, 124 с. (С. 131). В молекуле метана вершинами тетраэдра являются атомы водорода, центром тетраэдра – атом углерода.
[25] Особенность такой связи состоит в том, что она имеет только одну область перекрывания.
[26]π – связь отличается от σ – связи наличием двух областей перекрывания.
[27] Метановая, этановая и пропановая кислоты относятся к предельным кислотам
[28]Водородная связь представляет собой невалентное взаимодействие, обозначаемое тремя точками, например А – Н ... В, где В – атом, имеющий неподелённую электронную пару (N, O, S), A – атом, соединённый с водородом ковалентной связью. Это взаимодействие сводится к тому, что электрон атома водорода, смещаясь в сторону атома А, предоставляет свою, частично освобождающуюся орбиталь для пары электронов другой молекулы В. Многие физические свойства воды обусловлены именно водородной связью.
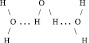
В этом случае А ≡ В ≡ О.
[29] Природные жиры относятся к липидам – обширной группе природных органических соединений, включающей жиры и жироподобные вещества.
[30] Термин «жирный» означает, что соединение ациклическое. Возник из-за того, что впервые природные карбоновые кислоты были выделены из жиров.
[31] Ферменты – это органические природные катализаторы биохимических процессов, протекающих в живых организмах.
[32] Организм может быть одноклеточным – самостоятельной свободноживущей клеткой, либо многоклеточным, т. е. представлять собой совокупность неразрывно связанных систем органов и тканей.
[33] Популяция – совокупность организмов одного вида, объединенная общностью территории, генофонда, экологической ниши.
[34] В настоящее время установлено, что вирусы, будучи неклеточными телами, при определённых условиях также проявляют все свойства живых организмов, представляя собой промежуточное звено между живыми и неживыми телами.
[35]Приведённую схему можно представить более строгим уравнением:
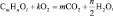 где
где 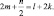
[36] Подробно строение молекулы белка рассматривается в курсе органической химии.
[37] Интересно отметить, что приведённые процессы нельзя отнести ни к одному из изученных Вами типов реакций: соединения, разложения, замещения, обмена. К окислительно-восстановительным процессам они также не относятся. Взаимодействие АТФ и АДФ с водой можно отнести к реакциям расщепления, характеризующимся тем, что одно из реагирующих веществ вступает в реакцию соединения (в данном случае вода ), а другое – в реакцию разложения (АТФ и АДФ).
[38] СПИД – синдром приобретенного иммунодефицита. Болезнь вызывается ВИЧ-инфекцией (ВИЧ – вирус иммунодефицита человека).
[39] Интересен вариант размножения морской губки: возможно разделить ее тело на множество фрагментов (и даже просеять через сито). Из каждого такого микрофрагмента вырастает отдельная особь.
[40]Независимо друг от друга в 1900 г. Гуго де Фриз (Голландия), К. Корренс (Германия). Э. Чермак (Австрия), переоткрыли законы Г. Менделя и признали его приоритет.
[41] Штамм – чистая культура микроорганизмов одного вида.
[42] Например, на Аляске, где очень сильные ветры, приспособились к обитанию и размножились воробьи с укороченными крыльями, у особей с обыкновенными крыльями был больший риск сломать крылья во время полета и погибнуть.
[43] Подразумевается, что другие особи являются частью окружающей среды.
[44] Под социальной эволюцией подразумевается изменение отношений между людьми в обществе.
[45] Эволюция в биологии – это необратимое историческое развитие живой природы сопровождающееся образованием и вымиранием видов.
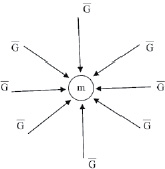
Рис. 1.2. Гравитационное поле,
создаваемое массой m; – напряжённость гравитационного поля
– напряжённость гравитационного поля
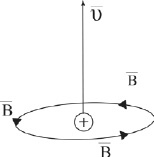
Рис. 1.6. Вихревое магнитное поле: – вектор скорости движения положительно заряженной частицы;
– вектор скорости движения положительно заряженной частицы;
 – вектор магнитной индукции
– вектор магнитной индукции
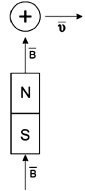
Рис. 1.9. Иллюстрация правила левой руки: сила, действующая на движущийся заряд, перпендикулярна плоскости рисунка и направлена
на читателя
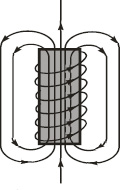
Рис. 1.11. Соленоид

Рис. 2.14. Концентрические круги, образуемые при реакции Белоусова-Жаботинского
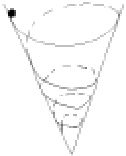
Рис. 2.17. Спиральная траектория движения шарика в воронке
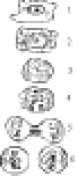
Рис. 3.18. Схема стадий митотического деления клетки:
1 – интерфаза;
2 – профаза;
3 – метафаза;
4 – анафаза;
5 – ранняя телофаза;
6 – поздняя телофаза, начало формирования ядер
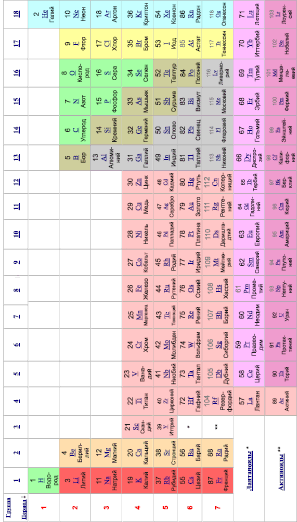
Форма периодической системы химических элементов, рекомендованная Международным союзом теоретической и прикладной химии (IUPAC) в 1989 году.
