Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
§ 2.1.3. Закон эквивалентов. Закон приведённого количества вещества
Закон эквивалентов гласит:
|
Вещества взаимодействуют друг с другом равными количествами молярных масс эквивалентов: |
nЭ1 = nЭ2,
где nЭ1 – количество молярных масс эквивалента одного вещества; nЭ2 – количество молярных масс эквивалента другого вещества, взаимодействующего с первым. Действительно, если рассчитать количества молярных масс эквивалентов взаимодействующих веществ для любой из рассмотренных выше реакций, то они окажутся равными.
Последнее равенство можно представить иначе:
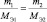
или 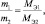
где m1 и m2 – массы реагирующих веществ; МЭ1 и МЭ2 – молярные массы их эквивалентов.
Все три последние равенства являются математическими формами записи закона эквивалентов.
Согласно закону эквивалентов для реакции:
k1А + k2B = k3C + k4D
должно выполняться
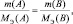
где m(A) и m(B) массы веществ А и В соответственно, МЭ(А) и МЭ(B) – молярные массы их эквивалентов. Или в соответствии с (2):
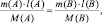
где M(A) и M(B) молярные массы веществ А и В, l(A) и l(B) количества активных связей в молекулах А и В соответственно.
После простейшего преобразования можно легко получить:
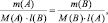
поскольку, в данном случае l(B) = k1; l(A) = k2, то:
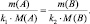 (2.3)
(2.3)
Так как последнее равенство справедливо для любой пары участвующих в реакции веществ (исходных и продуктов), то можно утверждать, что
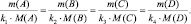
То есть, в пределах любой одной и той же химической реакции
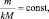 (2.4)
(2.4)
где 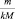 – приведённое количество вещества.
– приведённое количество вещества.
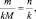
где n – количество вещества.
Приведённым количеством вещества называется отношение количества вещества к его стехиометрическому коэффициенту.
Равенства (2.3) и (2.4) представляют собой математические формы записи закона приведённого количества вещества, согласно которому
|
приведённые количества веществ участвующих в реакции (исходных и продуктов) равны между собой. |
Закон приведённого количества вещества вытекает также из простого анализа привычных пропорций:
k1А + k2B = k3C + k4D;

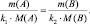
В общем случае

или 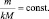
Согласно следствию закона приведённого количества вещества
|
приведённые количества элементов одного и того же сложного вещества равны между собой |
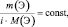
где m(Э) – масса или процентное содержание одного из элементов в данной навеске вещества; М(Э) – молярная масса этого элемента; i – индекс этого элемента в данном веществе, величина 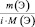 – приведённое количество элемента.
– приведённое количество элемента.
Иногда, в одной и той же реакции вещество может проявлять различные молярные массы эквивалента, что может некорректно восприниматься как нарушение закона эквивалентов. Например, при реакции разбавленной азотной кислоты с медью:
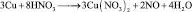 (2.5)
(2.5)
из восьми молекул азотной кислоты 2 молекулы являются окислителями, превращаясь в NO, а 6 молекул участвуют в процессе, не сопровождающемся изменением степени окисления. То есть, вся реакция делится на два взаимодействия:
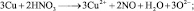

Хотя, реально частица O2– не существует, однако, из приведённой схемы видно, что в первом взаимодействии.
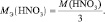
А во втором взаимодействии
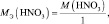
при этом, в обоих случаях закон эквивалентов выполняется – количества молярных масс эквивалентов всех взаимодействующих веществ и частиц равны шести.
При составлении уравнений окислительно-восстановительных реакций, стехиометрические коэффициенты перед восстановителем (kв), отдающим nв электронов, и перед окислителем (kо), принимающим nо электронов, можно рассчитывать с помощью следующих формул:
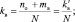 (2.6)
(2.6)
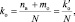 (2.7)
(2.7)
где mв – количество молекул восстановителя, не участвующих в восстановлении; mo – количество молекул окислителя, не принимающих участия в окислении; N – максимальное число, которому кратны все коэффициенты уравнения. Например, для реакции (2.5)
nо = 3; nв = 2; mo = 6; mв = 0; N = 1,
поэтому

Примеры решения задач
1. Пользуясь, следствиями закона эквивалентов, определить массу алюминия, израсходованного на получение 5,1 г оксида алюминия, если молярная масса алюминия 27 г/моль, молярная масса оксида алюминия 102 г/моль.
Прежде, чем приступить к решению подобной задачи целесообразно записать уравнение реакции
4Al + 3O2 = 2Al2O3.
|
Дано: m(Al2O3) = 5,1 г M(Al) = 27 г/моль М(Al2O3) = 102 г/моль k1 = 4 моль k2 = 2 моль |
Решение: Согласно следствию закона эквивалентов:
или |
|
m(Al) – ? |
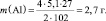
Ответ: m(Al) = 2,7 г.
2. Пользуясь равенствами 2.6 и 2.7 расставить коэффициенты в схеме реакции взаимодействия цинка с очень разбавленной азотной кислотой:
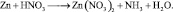
Решение
В данной реакции окислителем является азотная кислота, в которой атом азота принимает 8 электронов, то есть nо = 8. Поскольку mв = 0, то 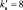 . Окисленной формы цинка в правой части уравнения также должно быть 8 атомов.
. Окисленной формы цинка в правой части уравнения также должно быть 8 атомов.
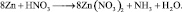
Из последней схемы видно, что mo = 16; nв = 2. Следовательно 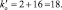 Восстановленной формы азота в правой части уравнения должно быть только два атома
Восстановленной формы азота в правой части уравнения должно быть только два атома
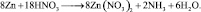
Все коэффициенты можно сократить на 2, то есть в данном случае N = 2. Поэтому, окончательно kв = 4; kо = 9
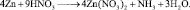
Задачи для самостоятельного решения
1. Пользуясь законом приведённого количества вещества, определить массу сульфита натрия, необходимую для полного превращения 0,2 моль перманганата калия в сульфат марганца по реакции:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O. (2.8)
Сколько грамм воды выделится в результате этой реакции?
2. Определить массу бихромата калия, необходимую для полного превращения 49,8 г. иодида калия в йод по реакции:
K2Cr2O7 + 7H2SO4 + 6KI = Cr2(SO4)3 + 4K2SO4 + 3I2 + 7H2O. (2.9)
Сколько грамм йода образуется в результате этой реакции?
Решить задачу двумя способами – пользуясь пропорциями и пользуясь законом приведёного количества вещества.
3. Пользуясь законом приведённого количества вещества, определить химическую формулу оксида меди, если в нём содержится 89 массовых процента меди, и 11 массовых процента кислорода.
4. Пользуясь равенствами (2.6) и (2.7) расставить коэффициенты в схеме реакции:
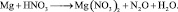
1. Сформулируйте закон эквивалентов и закон приведённого количества вещества.
2. Что такое приведённое количество вещества?
3. Выведите закон приведённого количества вещества из закона эквивалентов.