
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ПАРАТГОРМОН-РОДСТВЕННЫЙ ПРОТЕИН
Курзанов А. Н., Ледванов М. Ю., Быков И. М., Медведев В. Л., Стрыгина Е. А., Бизенкова М. Н., Заболотских Н. В., Ковалев Д. В., Стукова Н. Ю.,
5.5. Использование анаболического эффекта пептидного фрагмента паратгормон-родственного протеина для лечения остеопатий
ПТГрП играет существенную роль в эндохондральной оссификации, и синтетический аналог этого белка может иметь сильную костную анаболическую активность; однако использование таких новых и высокоэффективных терапевтических принципов связано с новыми вопросами и неопределенностями в отношении последовательности терапии, продолжительности терапии, долгосрочных побочных эффектов, нежелательной активации метаболических путей и эффективности по сравнению с другими терапевтическими стратегиями (Knauerhase A., Willenberg H.S., 2016).
Анаболические остеотропные эффекты паратгормона и паратгормон-родственного белка послужили основанием для изучения возможности использования фукционально активных доменов и их синтетических аналогов в терапевтических целях при остеопатиях и в первую очередь при остеопении и остеопорозе (Esbrit P., Alcaraz V.J., 2013; Esbrit P., et al., 2016; Goltzman D., 2008) и в том числе при глюкокортикоид-индуцированном остеопорозе (de Castro L.F., et al., 2010) и остеопении связанной с диабетом (Lozano D., et al., 2009; Lozano D., et al., 2011; Maycas M., et al., 2017). Основная цель лечения остеопороза заключается в снижении риска переломов за счет повышения прочности костей, а золотым стандартом в оценке эффективности влияния лечения на прочность кости является исследование с помощью компьютерной томографии высокого разрешения в сочетании с тестированием биомеханических показателей (Bahar H., et al., 2016). Риск перелома у пациентов с остеопорозом является многофакторным. Среди скелетных признаков, которые способствуют риску переломов, преобладают показатели костной массы и прочности костной ткани. Только масса костей может объяснить 70–90 % изменения структурной прочности костей человека и животных (Augat P., et al., 1998; Bouxsein M.L., et al., 1999; Ominsky M.S., et al., 2008). Увеличение прочности костной ткани на разных участках скелета, выявленное у экспериментальных животных, может совпадать с связанными с лечением сокращениями риска переломов на соответствующих скелетных участках у людей (Kostenuik P., 2013). Данные плацебо-контролируемых клинических испытаний различных антирезорбтивных средств также указывают на то, что фиксируемое при этом увеличение минеральной плотности костной ткани (МПКТ), может быть хорошим предиктором снижения риска переломов (Hochberg M.C., et al., 1999; Hochberg M., et al., 2002; Austin M., et al., 2011). Связь между изменениями костной массы и снижением риска переломов не столь очевидна для костных анаболических агентов, таких как терипаратид [rhPTH (1-34)] и rhPTH (1-84)].
Лечение остеопороза осуществляется, как правило, либо путем ингибирования резорбции кости антирезорбтивными агентами либо посредством стимуляции образования костной ткани с использованием анаболических средств (Tabatabaei-Malazy O., et al., 2017). Остеоанаболическое лечение является наиболее подходящим для пациентов, у которых уже наблюдались переломы, связанные с остеопорозом, или у которых очень низкий уровень МПКТ или имеются другие факторы риска. У этих пациентов существенные количественные и микроструктурные скелетные дефициты с большей вероятностью будут улучшены или отменены с помощью анаболической терапии по сравнению с антирезорбтивной терапией (Dempster, D.W., et al., 2001; Jiang, Y., et al., 2003; Cummings, S.R., et al., 2013).
Остеоанаболическое лечение может быть применено у пациентов с остеопорозом на разных стадиях заболевания, включая пациентов с предшествующими переломами, и пациентов с очень низким показателем МПКТ. У пациентов с переломами костей в анамнезе, особенно недавних переломов, неизбежный риск последующих переломов высок (Giangregorio L.M., Leslie W.D., 2010; Cosman F., et al., 2014; van Geel T.A., et al., 2010). Такие пациенты нуждаются в лечении, которое может привести к быстрому снижению риска дальнейших переломов, в конечном итоге восстановить некоторые из основных дефектов костной ткани и улучшить прочность костной массы. Для пациентов с очень низкой костной массой, но без перелома в анамнезе, неизбежный риск может быть умеренным, но долгосрочный риск перелома остается высоким (Cauley J.A., et al., 2007). У таких пациентов начало терапии остеопороза остеоанаболическим препаратом может быть наиболее эффективным способом достижения конечных целей борьбы с остеопорозом. (Hodsman A.B., et al., 2005). Таким образом, существует потребность в скелетной анаболической терапии, которая может увеличить минеральную плотность костной ткани (МПКТ) при одновременном снижении риска переломов путем стимуляции нового роста кости, которая является безопасной, хорошо переносимой и позволяющей достичь большего эффекта по сравнению с использованием антирезорбтивных препаратов (Dede A.D., et al., 2017). Анаболические агенты, которые стимулируют образование костной ткани, являются идеальными для лечения пациентов, страдающих остеопорозом.(Augustine M., Horwitz M.J., 2013).
Анализ существующей информации, связанной с созданием фармпрепаратов остеоанаболического действия, совершенно однозначно свидетельствует о первостепенном значении в реализации остеотропных эффектов взаимодействия биологически активных доменов ПТГ или ПТГрП с их общим рецептором ПТГ/ПТГрП. В этой связи рассмотрение имеющихся в литературе данных о создании формпрепарата на основе пептидного домена ПТГрП (что обозначено в названии данной главы) неотделимо от упоминаний существующих сведений о первом остеоанаболическом препарате, разработанном 15-ю годами раньше на основе пептидного фрагмента ПТГ. Такой подход к анализируемой теме связан еще и с тем, что в подавляющем большинстве исследований, результаты которых явились обоснованием создания нового фармпрепарата –аналога пептидного домена ПТГрП, проводилось прямое сопоставление остеотропных эффектов эти двух лигандов ПТГ/ПТГрП-рецепторов. Сказанное объясняет присутствие в тексте данной главы информации о фармпрепарате остеоанаболического действия-аналоге фрагмента ПТГ-терипаратида.
До самого последнего времени фармпрепарат Форстео (Forsteo®), действующим началом которого является терипаратид (рекомбинантный биоактивный фрагмент человеческого паратиреоидного гормона. [rhPTH (1-34)], являлся единственным доступным одобренным остеоанаболическим средством в США (Polyzos S.A., et al., 2015; Anastasilakis A.D., et al., 2008; Dempster D.W., et al., 2012; Han S.L., Wan S.L., 2012). Биологическое действие терипаратида осуществляется за счет связывания со специфическими рецепторами паратгормона на поверхности клеток и состоит в аналогичном эффектам паратгормона действии на кости и почки. Введение терипаратида стимулирует образование новой костной ткани на трабекулярной и кортикальной (периостальной и/или эндостальной) поверхностях костей с преимущественной стимуляцией активности остеобластов по отношению к активности остеокластов. Это подтверждается повышением содержания маркеров образования костной ткани в сыворотке крови: костноспецифической щелочной фосфатазы и карбокситерминального пропептида проколлагена I типа. Повышение содержания маркеров образования костной ткани сопровождается вторичным повышением уровня маркеров костной резорбции в моче: N-телопептида и дезоксипиридинолина, что отражает физиологическое взаимодействие процессов формирования и резорбции костной ткани в ремоделировании скелета.
Терипаратид (Teriparatide) одобрен в США для лечения остеопороза у лиц с высоким риском переломов, включая женщин в постменопаузе, у мужчин с первичным гипогонадизмом или остеопорозом и у мужчин и женщин с остеопорозом, индуцированным глюкокортикоидами (Eli Lilly and Company: Forteo Prescribing information. Available at http://pi.lilly.com/us/forteo-pi.pdf). В июне 2003 года FORSTEO утвержден Европейской комиссией по лечению остеопороза у женщин и получил одобрение регулирующих органов во всех странах-членах Европейского Союза для лечения остеопороза у женщин в постменопаузе. В ноябре 2013 года в рамках V Российского конгресса по остеопорозу и другим метаболическим заболеваниям скелета фармацевтическая компания Eli Lilly объявила о выходе на российский рынок препарата Форстео (терипаратид) для лечения тяжелого остеопороза. (https://vademec.ru/news/2013/11/19/forsteo_formiruet_novuyu_kost/). Тeрипаратид является эффективным и безопасным анаболическим препаратом и его внедрение существенно изменило лечение остеопороза. У женщин в постменопаузе с остеопорозом, получавших ежедневные инъекции 20 мкг терипаратида риск переломов позвонков был снижен на 65 % и риск внепозвоночных переломов был снижен на 53 % по сравнению с пациентками, которые получали плацебо. Также зафиксировано увеличение МПКТ позвонков и бедренной кости (Neer R.M., et al., 2001). Терипаратид увеличивает образование губчатого вещества кости, главным образом, на участках, подвергающихся активному ремоделированию, но имеет ограниченное влияние на формирование надкостницы и увеличивает пористость кортикального слоя (Compston J.E., 2007; Augustine M., Horwitz M.J., 2013).
У женщин с остеопорозом, лечение терипаратидом снижает риски вертебральных и внепозвоночных переломов. Тем не менее применение терипаратида имеет два важных ограничения, которые представлены необходимостью вводить препарат посредством ежедневных подкожных инъекций, а также тем, что продолжительное лечение терипаратидом приводит не только к формированию новой костной ткани, но и одновременно стимулирует резорбцию кости, что приводит к постепенному снижению анаболического эффекта. Применение терипаратида ограничено у некоторых пациентов развитием мягкой гиперкальциемии, мышечных судорог, а также других случайных побочных эффектов (Neer R.M., et al., 2001; Capriani C., et al., 2012). Это стимулировало поиск других ПТГ и ПТГрП аналогов, которые были бы чисто анаболическими, стимулируя образование костной ткани без стимуляции ее резорбции (Augustine M., Horwitz M.J., 2013). Было проведено прямое сравнения остеотропных эффектов ПТГ (1-34), ПТГрП (1-36) и аналога ПТГ SDZ-ПТГ 893 в естественных условиях в модели постклимактерического остеопороза у взрослых крыс получавших по 40 мкг/кг массы тела в день одного из исследованных веществ. Установлено, что у животных всех трех групп получавших пептиды увеличилась масса кости (по данным денситометрии и по показателю массы костной золы), улучшились гистоморфометрические характеристики трабекулярной и кортикальной кости и биомеханические свойства по данным исследования прочности тел позвонков и диафиза бедренной кости, а также заметно возросли показатели образования костной ткани. Степень выраженности позитивных эффектов в сравнительном ряду: SDZ-ПТГ-893 > ПТГ > ПТГрП. Выраженность негативных эффектов также было наибольшей при введении животным SDZ-ПТГ-893. Все три пептида признаны перспективными в качестве скелетных анаболических агентов (Stewart A.F., et al., 2000).
Другой формой паратгормона для терапевтического использования в Европе, но не в Соединенных Штатах, является ПТГ 1-84. Было показано, что ежедневное подкожное введение РТН 1-84 100 мкг в течение 18 месяцев снижает риск возникновения новых переломов позвонков на 58 % у женщин в постменопаузе с остеопорозом. Несмотря на увеличение МПКТ бедренной кости, а также позвоночника, частота внепозвоночных переломов у испытуемых, получавших ПТГ 1-84 была сопоставима с группой, получавшей плацебо (Greenspan S.L., et al., 2007). Поскольку при использовании ПТГ 1-84 не зафиксировано лучших эффектов в отношении риска переломов по сравнению с терипаратидом и поскольку существует более высокая частота гиперкальциемии и гиперкальциурии (Migliore A., et al., 2012) утверждение ПТГ 1-84 в качестве средства для лечения остеопороза в США больше не рассматривается. В недавнем исследовании с использованием периферической количественной компьютерной томографии высокого разрешения (HR-pQCT) для характеристики костной микроархитектуры и расчетной прочности у женщин в постменопаузе с остеопорозом, получавших лечение с ПТГ 1-34 или ПТГ 1-84 в течение 18 месяцев, зафиксировано увеличение толщины кортикального слоя и количества трабекулярного компартмента большеберцовой кости при использовании обоих форм препарата. Расчетная прочность кости была сохранена при введении ПТГ 1-34, но снизилась после применения ПТГ 1-84 (Hansen S., et al., 2013).
Исследования на животных и многочисленные сообщения о клинических наблюдениях позволили предположить, что терипаратид и ПТГ 1-84 могут ускорить заживление переломов. Рекомбинантный ПТГ использовали для для лечения различных острых переломов и особенно в случаях замедленного срастания поврежденной кости на протяжении от 2 месяцев до 2-х лет (Zhang D., et al., 2014). У женщин в постменопаузе с переломом таза среднее время заживления поврежденных костных структур составило 7,8 недель в группе пациенток пролеченных с использованием РТН 1-84 в дозе 100 мкг, по сравнению с контрольной группой, получавшей плацебо, в которой этот процесс длился 12,6 недель (Peichl P., et al., 2011). Эти исследования показали, что некоторое уменьшение времени заживления трещины может быть достигнуто при ежедневном введении ПТГ. Большие рандомизированные контролируемые исследования необходимы, чтобы определить оптимальную продолжительность терапии, сроков начала и ожидаемые результаты. Кроме того, целесообразно определить, являются ли относительно небольшие изменения во времени заживления достаточно экономически значимыми, чтобы использовать дорогостоящее лечение с ежедневным введением ПТГ. Эти авторы считают вполне вероятным, что в ближайшем будущем, анаболические агенты могут иметь большую роль в улучшении заживления медленно срастающихся повреждений костных структур, а не в неотложной помощи при переломах.
Поскольку ПТГрП связывается с рецептором ПТГ/ПТГрП и активирует передачу сигнала с одинаковой эффективностью как и ПТГ, было исследовано, может ли ПТГрП также выступать в качестве костного анаболического средства при прерывистом введении. В одном из первых клинических исследований 16 женщин в постменопаузе с остеопорозом были рандомизированы для получения ежедневных подкожных инъекций синтетического человеческого ПТГрП 1-36 (6,56 мкг/кг) или плацебо в течение трех месяцев. Все испытуемые были на заместительной гормональной терапии, которая была продолжена и получали пищевые добавки с витамином D и кальцием начиная за 2 недели до начала инъекций исследуемого препарата или плацебо. МПКТ поясничного отдела позвоночника увеличилась на 4,7 % по сравнению с исходным показателем у пациентов получавших ПТГрП 1-36. Маркеры формирования кости были увеличены, тогда как маркеры резорбции не изменились, предполагая, что введение ПТГрП 1-36 может иметь чисто остеоанаболический эффект и, возможно, не сопровождается сопутствующем увеличением резорбции кости, наблюдаемой при инъекциях ПТГ (Horwitz M.J., et al., 2003). Последующее исследование увеличения дозы ПТГрП 1-36 показало, что при дозах выше 750 мкг/сут, образование костной ткани избирательно активируется (Horwitz M.J., et al., 2010).
Исследование эффективности и безопасности ежедневного подкожного введения ПТГрП (1-36) показало, что он безопасен, эффективен и хорошо переносится при применении в течение до трех месяцев (Horwitz M.J., et al., 2003; Horwitz M.J., et al., 2006). Это первое непосредственное сравнение эффектов РТН (1-34) и PTHrP (1-36) примененных для лечения низкой плотности костной ткани и остеопороза. Основные выводы наблюдения состоят в том, что оба пептида стимулируют образование костной ткани и оба пептида влияют аналогичным образом на изменения МПКТ в позвоночнике. Введение ПТГрП (1-36) вызывало меньшую резорбцию кости по сравнению с ПТГ (1-34). Оба пептида стимулировали увеличение концентрации в крови 1,25 (OH)2 D. Увеличение содержания в циркуляторном русле 1,25 (OH)2 D может также способствовать скелетным анаболическим эффектам обоих пептидов. В этих исследованиях ПТГрП (1-36), как представляется, отличается от ПТГ (1-34) в двух важных моментах. Во- первых, ПТГрП (1-36) не был связан с гиперкальциемией в терапевтических дозах (400 мкг/сут). Во- вторых, он не активировал маркеры костной резорбции в клинически значимых дозах. (Horwitz M.J., et al., 2010). Таким образом, в отличие от ПТГ (1-34), ПТГрП (1-36) индуцирует чистый анаболический скелетный эффект. В целом зафиксированные в данном исследовании эффекты ПТГрП (1-36) во многом аналогичны действию ПТГ (1-34), с точки зрения эффективности, безопасности и переносимости препарата у больных с постменопаузальным остеопорозом.
Эффекты ПТГрП (1-34) на изменение массы костной ткани в естественных условиях исследовали в экспериментах с использованием динамической модели остеогенеза (Pettway G.J., McCauley L.K., 2008). Было показано, что введение ПТГрП (1-34) мышам с эктопически пересаженными позвонками (модель vossicle) усиливает их приживление и увеличивает костную массу этих имплантов, что фиксировали методом неинвазивного мониторинга на основе анализа биолюминесценции и флуоресцентных изображений (Hildreth B.E., et al., 2015). Прерывистое введение ПТГрП (107-139) (Richard V., et al., 2003), включающего в себя всю С-концевую область мажорной изоформы ПТГрП, оказывает остеогенный эффект в различных моделях остеопороза у мышей (de Castro L.F., et al., 2012; de Castro L.F., et al., 2010; Lozano D., et al., 2011). Полагают, что эти действия С-концевого пептида ПТГрП реализуются при участии остеостатина (Lozano D., et al., 2010).
В экспериментах с использованием крысиной модели остеопороза изучили влияние ПТГрП (1-34) на метаболизм костной ткани путем измерения минеральной плотности костной ткани (МПКТ), а также путем исследования гистоморфометрических и биомеханических параметров кости. Установлено, что ежедневное подкожное введение ПТГрП овариэктомированным крысам увеличивает показатели минеральной плотности поясничных позвонков и бедренной кости, улучшает биомеханические свойства костей, повышает прочность кости, и способствует формированию новой костной ткани. Полученные результаты указывают на высокий потенциал терапевтического применения ПТГрП (1-34) при остеопорозе (Xu J., et al., 2013). Согласно доклиническим данным, ежедневная подкожная инъекция человеческого ПТГрП (1-36) может стимулировать образование костной ткани без значительного увеличения костной резорбции или ожидаемых побочных эффектов, таких как гиперкальциемия. Таким образом ПТГрП (1-36) может быть одним из перспективных остеотропных препаратов для лечения остеопороза (Takeuchi Y., 2011).
В одном из ранних исследований женщинам в постменопаузе с дефицитом эстрогенов вводили ежедневно подкожно ПТГрП-(1-36) в течение 14 дней, чтобы определить его влияние на остеогенез в дозах, которые не изменяют системный минеральный гомеостаз, но увеличивают маркеры обмена костной ткани. Было установлено, что, введение ПТГрП (1-36) разобщает процессы образование костной ткани от ее рассасывания, в пользу остеогенеза. Эти данные позволили авторам предсказать, что ПТГрП (1-36) может быть мощным анаболическим терапевтическим средством для лечения остеопороза (Plotkin H., et al., 1998).
В последние годы существует большой интерес к изучению аналогов ПТГрП в качестве потенциальных чистых анаболических агентов, которые могут применяться при остеопорозе. В лаборатории Roche Bioscience был разработан синтетический аналог фрагмента ПТГрП, который обозначили как «RS-66271» (Vickery B.H., et al., 1996). Анаболические остеотропные эффекты RS-66271 и ПТГрП (1-34) были исследованы в экспериментах на овариэктомированных крысах с выраженными проявлениями остеопении. Подкожное введение ПТГрП (1-34) (80 мкг/кг) один раз в сутки частично восстанавливало эстрогениндуцированную потерю губчатой кости, но было неэффективным в кортикальном слое кости. В отличие от этого, после введения животным с остеопенией RS-66271 в такой же дозе отмечено восстановление и трабекулярной и кортикальной костной ткани большеберцовой кости до уровня ложнооперированных животных, что подтверждено данными гистоморфометрического исследования. С помощью электронной микроскопии показано увеличение относительной площади поверхности трабекул тел позвонков, покрытых остеобластами у животных, получавших RS-66271. Эти исследования показали, что новый синтетический аналог имеет большую остеоанаболическую активность, чем анаболический эффект исходного пептида. Полученные результаты позволили заключить, что RS-66271 может быть перспективным кандидатом в фармпрепараты для лечения остеопороза.
В доклинических исследованиях in vivo и in vitro исследовали особенности взаимодействия RS-66271 и рекомбинантного человеческого ПТГ (1-34) (LY333334) с рецептором ПТГ/ПТГрП и сравнили их фармакологические эффекты (Frolik C.A., et al., 1999). Оба пептида также показали равную способность стимулировать производство цАМФ в крысиных остеобластах клеточной линии типа UMR-106, в то время как в остеобластоподобных человеческих клетках линии СДЛ-2 человека RS-66271 был в 7,6 раз менее активен в стимулировании продукции инозитолфосфата. В исследованиях in vivo молодые самцы крыс получали ежедневно подкожно дозу 10 или 40 мкг пептида на кг массы тела на протяжении 1, 2 или 4 недель. Объемную МПКТ проксимального отдела большеберцовой кости определяли с помощью периферической количественной компьютерной томографии. В трабекулярной и кортикальной частях дистального отдела бедренной кости анализировали содержание кальция и сухой вес. Поясничные позвонки (L4-L6) анализировали спомощью гистоморфометрии. Выявлено зависимое от дозы пептида и длительности его введения увеличение губчатой и кортикальной костной массы посравнению с контрольной группой. Эти изменения были очевидны уже в 1 неделю после начала приема препарата. Несмотря на сниженую аффинность связывания RS-66271 с ПТГ/ПТГрП рецептором по сравнению с ПТГ (1-34), оба пептида демонстрировали сходные in vivo и in vitro биологическую активность и фармакологические эффекты. Этот же аналог ПТГрП RS-66271 (Семпаратид ацетат) был изучен в двух рандомизированных плацебо-контролируемых исследованиях по оценке влияния на МПКТ у женщин с постменопаузальным остеопорозом. На фоне терапии семпаратидом биохимические маркеры костеобразования (сывороточный проколлаген I типа, костная щелочная фосфатаза, остеокальцин) и резорбции (деоксипиридинолин и N-телопептид/креатинин в моче) продемонстрировали дозозависимое увеличение уже через три недели после начала лечения. Результаты исследования показывают, что ежедневное применение семпаратида при постменопаузальном остеопорозе приводит к быстрому и достоверному увеличению МПКТ позвонков и бедренной кости, которое сохраняется через 6 месяцев после прекращения лечения (Gallagher J.C., 1999).
Биофармацевтическая компания «Radius Health» разработала фармпрепарат абалопаратид (Abalaparatid), известный ранее как BA058, являющийся рекомбинантным пептидным аналогом человеческого ПТГрП (1-34), который позиционируется как средство для лечения остеопороза и снижения риска переломов в критических анатомических участках скелета (Leder B.Z., et al., 2015). Абалопаратид был выбран для такой терапии на основе доклинических испытаний, которые продемонстрировали способность этого пептида стимулировать образование костной ткани с уменьшенной костной резорбцией и сопутствующей гиперкальциемией по сравнению с наблюдаемым при использовании аналога фрагмента РТН (1-34) (Culler M., et al., 2001; Doyle N., et al., 2013). Абалопаратид представляет собой синтетический 34-аминокислотный пептид взаимодействующий
с ПТГ/ПТГрП-рецептором (PTHR1). Абалопаратид имеет молекулярную формулу C 174 H299 N56 O49 и молекулярную массу 3961 дальтон с аминокислотной последовательностью: H-Ala-Val-Ser-Glu-His-Gln-Leu-Leu-His-Asp-Lys-Gly-Lys-Ser-Ile-Gln-Asp-Leu-Arg-Arg-Arg-Glu-Leu-Leu-Glu-Lys-Leu-Leu-Ala-Lys-Leu-His-Thr-Ala-NH2 (рис. 16).
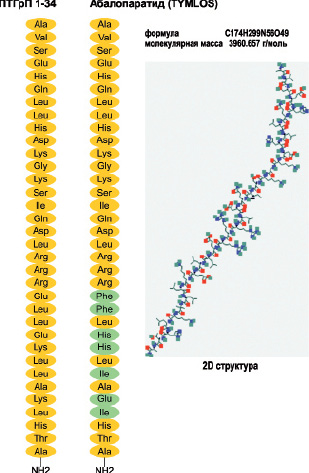
Рис. 16. Структура абалопаратида имеет 41 % гомологии с ПТГ (1-34) и 76 % гомологии с ПТГрП (1-34). Первые 21 аминокислотных остатка идентичны с ПТГрП (1-34), а остальные содержат ряд замен, которые были выполнены для повышения стабильности структуры. Замены аминокислотных остатков обозначены зеленым цветом. Изображение 2D структуры представлено в базе данных открытой химии PubChem (CID 76943386)
Эти структурные особенности абалопаратида определили его, как аналог ПТГрП, представляющий собой мощный селективный активатор сигнального пути ПТГ/ПТГрП-рецептора ((Dong J., et al., 2001; Hattersley G., et al., 2016; Varela A., et al., 2017a). Растущий интерес к абалопаратиду основывается на результатах некоторых исследований на животных и людях, которые показали, что этот синтнтический пептид обладает мощной и быстрой анаболической активностью с уменьшенным эффектом резорбции костной ткани по сравнению с терипаратидом и улучшенными характеристиками стабильности (Hattersley G., et al., 2016; Doyle N., et al., 2013; Xu J., et al., 2013). В клеточной линии человеческих остеобластов абалопаратид и терипаратид увеличили экспрессию факторов связанных с формированием и резорбцией костной ткани(RANKL и М-CS мРНК), но эти эффекты были быстро устранены после удаления абалопаратида из культуральной среды, в то время как в клетках обработанных терипаратидом они были более длительными (Makino A., et al., 2015). Для абалопаратида, как и для любого остеоанаболического агента, доказательства значимой связи между изменением МПКТ и снижением риска разрушения кости основаны на установлении четкой, последовательной и благоприятной взаимосвязи между массой кости и ее структурной прочностью. Неклиническая оценка прочности кости и качества костной ткани может предоставить важные данные о влиянии исследуемых веществ на состояние костной ткани. Исследования на животных позволяют провести тестирование прочности кости на клинически значимых участках, таких как длинные кости, шейка бедренной кости и позвонки, а также возможность оценки ex vivo массы, плотности и геометрии образцов кости до биомеханического тестирования. Эти особенности устраняют определенные ограничения клинической денситометрии, такие как артефакт движения и интерференция мягких тканей.
Доклинические исследования, проведенные на животных, показали заметную остеотропную анаболическую активность абалопаратида у овариэктомированных крыс получавших препарат после развития остеопении. Цель этих исследований состояла в определении долгосрочных эффектов воздействия абалопаратида на массу костной ткани, как кортикальной так и губчатой кости, которые оценивали по показателю МПКТ, определяемой периферической количественной компьютерной томографией и прочности кости, определяемой путем биомеханического тестирования. Механизмы, с помощью которых абалопаратид влияет на кости исследовали путем оценки биомаркеров ремоделирования кости и гистоморфометрических показателей метаболизма костной ткани. Данные, полученные в исследовании на крысах показали дозозависимое увеличение МПКТ после введения абалопаратида, увеличение маркеров формирования костей, но не маркеров ее резорбции, а также увеличение прочности кости (Xu J., et al., 2013).
В исследовании на животных (Bahar H., et al., 2016) с моделированием остеопороза оценивали влияние 6-недельного ежедневного введения абалопаратида на кость у взрослых крыс. Общая МПКТ была измерена методом двойной рентгеновской абсорбциометрии invivo в конце 8-недельного периода после овариэктомии. Эти данные верифицировали развитие остеопении всей бедренной кости, диафиза бедренной кости и поясничного позвонка. Оценку трабекулярной архитектуры в поясничном позвонке (L4) и метафазе дистального отдела бедренной кости и геометрии кортикальной кости проводили с использованием микрокомпьютерной томографии при использовании модели ex vivo. Были также оценены морфометрические параметры, включая объемную долю кости, объем кости, трабекулярное число, толщина трабекулы, трабекулярный интервал, плотность связи и плотность кости, площадь и толщина кортикальной кости. Зафиксированные измененния МПКТ в области позвоночника и бедренной кости, по всей видимости, опосредованы главным образом увеличением объема трабекулярной и кортикальной кости. Улучшения в кортикальной кости были очевидны по показателям увеличенной МПКТ в середине диафиза бедренной кости, а также по данным микрокомпьютерной томографии свидетельствующих об увеличении объема и толщины кортикальной кости. Индуцированные абалопаратидом лучшения в губчатой кости были выявлены в результате оценки состояния костной ткани в позвонке (L4) и дистального отдела метафиза бедренной кости, которая продемонстрировала увеличение объема губчатой кости и ее МПКТ, а также улучшение трабекулярной микроархитектуры. Позвонки были протестированы в деструктивном биомеханическом испытании на сжатие. Полученные
результаты, впервые описывают действие абалопаратида на прочность кости, указывают на то, что лечение экспериментально смоделированной остеопении с помощью абалопаратида полностью восстановило вызванную потерю костной ткани и увеличивало прочность кости на поясничном отделе позвоночника, диафизе бедра и шейке бедра крыс. Оценка прочности кости была проведена на участках скелета, которые соответствуют областям с повышенным риском переломов у женщин в постменопаузе. Биомеханическия оценка кости показала существенное улучшение ее структурной прочности у животных, получавших абалопаратид. Параметры костной массы и прочности у животных с экспериментальным остеопорозом, получавших инъекции абалопаратида превышали таковые у контрольных животных с неудаленными яичниками, что еще больше подчеркивает мощный анаболический потенциал этого аналога ПТГрП. Авторы исследования заключили, что увеличение прочности костных структур под влиянием абалопаратида в значительной степени зависит от увеличения плотности и объема костной массы. Эти наблюдения изменения костной массы под влиянием абалопаратида у крыс с экспериментальной остеопенией согласуются с данными продемонстрировавшими увеличение МПКТ зафиксироваными в фазе 2 клинических испытаний лечебных эффектов абалопаратида у женщин с постменопаузальным остеопорозом (Leder B.Z., et al., 2015).
В другом экспериментальном исследовании, проведенном на крысах с остеопенией, индуцированной удалением яичников изучали механизмы, с помощью которых абалопаратид увеличивает костную массу. Животные получали ежедневные подкожные инъекции препарата на протяжении 12 месяцев. По данным денситометрических, биохимических и гистоморфометрических исследований установлено, что на фоне введения абалопаратида увеличились биохимические маркеры формирования костной ткани без увеличения маркеров резорбции кости и без гиперкальциемии. Абалопаратид увеличил гистоморфометрические показатели формирования кости на трабекулярной, эндокортикальной и периостальной поверхностях без увеличения остеокластогенеза, индуцировал значительное увеличение трабекулярного объема костной ткани, ее плотности и улучшения в трабекулярной микроархитектуры. Абалопаратид стимулировал периостальное увеличение кости и увеличению объема кортикальной костной ткани большеберцовой кости. МПКТ у крыс с остеопенией увеличилась на 25 % после 12 месяцев введения абалопаратида. Полученные данные позволили предположить, что зафиксированные измененияв кортикальной и губчатой костной ткани связаны с селективными анаболическими эффектами абалопаратида, при отсутствии одновременной активации резорбции кости (Varela A., et al., 2017a).
В этой же лаборатории исследовали влияние 12-месячного введения абалопаратида на массу, прочность и качество костной ткани у остеопенических овариэктомированных крыс (Varela A., et al., 2017b). Эффекты широкого (25-кратного) диапазона доз абалопаратида оценивались по структурным биомеханическим свойствам поясничного позвонка, диафиза бедренной кости и шейки бедра в сочетании с оценками костной массы, плотности и геометрии ex vivo. Качество костной ткани оценивали путем оценки взаимосвязи между массой кости и ее структурной прочностью. Денситометрия костей и периферическая количественная компьютерная томография были проведены in vivo до операции, в конце периода развития остеопении и через 3, 6 и 12 месяцев введения абалопаратида. Денситометрия in vivo показала заметный прирост костной массы у животных получавших абалопаратид в трабекулярных и корковых участках, включая устойчивое увеличение МПКТ по всему скелету. Увеличение объема кортикальной кости большеберцового диафиза было обусловлено увеличением костной массы на надкостничной и эндокортеральной поверхностях. В соответствии с приростом массы и объема трабекулярной и кортикальной кости, введение абалопаратида обусловило дозозависимое повышение прочности костной ткани в поясничном позвонке, бедренном диафизе и шейке бедра. Это исследование показало, что длительное ежедневное введение абалопаратида крысам с экспериментальной остеопенией дозозависимо увеличивает костную массу и прочность в поясничном отделе позвоночника, голени и бедренной кости. Это увеличение дополнительно сопровождалось улучшенной геометрией кортикального компартмента костной ткани, повышенной структурной прочностью кости и сохранением или улучшением ее изученных свойств.
Результаты исследования на овариэктомированных обезьянах, которым после окончания периода развития остеопении ежедневно вводили абалопаратид также позволили зафиксировать заметный анаболический эффект. Отмечен значительный прирост МПКТ, а также увеличение прочности кости и маркеров формирования костной ткани. Введение абалопаратида привело к полному восстановлению индуцированной овариэктомией потери прочности тела позвонков, шейки бедренной кости, увеличению МПКТ метафиза большеберцовой кости. Это исследование показало, что абалопаратид способствует быстрому формированию качественно новой костной ткани у обезьян с остеопенией, а также улучшение прочности костей в клинически значимых участках (Doyle N., et al., 2013).
Сообщалось, что абалопаратид и терипаратид имеют сравнимую эффективность в предупреждении разрушения позвоночника у женщин в постменопаузальном периоде с возможным более ранним и более выраженным эффектом абалопаратида в снижении риска основных костных событий связанных с остеопорозом (Miller P.D., et al., 2016; Cosman, F., et al., 2017; Leder B.Z., et al., 2015). Результаты испытаний на основании данных двойной рентгеновской абсорбциометрии и биохимических маркеров костного метаболизма зафиксировали высокую эффективность абалопаратида (ВА058) в стимуляции роста и увеличения МПКТ в бедренной кости, шейке бедренной кости и в поясничном отделе позвоночника у женщин в постменопаузе с остеопорозом (Leder B.Z., et al., 2015; Augustine M., Horwitz M.J. 2013). Эти эффекты значительно превосходили аналогичное действие на костную ткань терипаратида.
Однако сравнительная оценка анаболических эффектов терипаратида и абалопаратида имеет немало дискуссионных моментов, и противоречивых логических умозаключений. Основная причина этих дискуссий состоит в различной трактовке зафиксированных во многих исследованиях эффектов обоих лигандов ПТГ/ПТГрП-рецептора (Martin T.J., Seeman E., 2017). Является ли это результатом недостаточной эффективности терипаратида и свидетельством эффективности абалопаратида? Определение преимущества одного препарата над другим является сложной задачей, особенно когда анализируемые в ходе исследования события (костные переломы) являются в общем-то нечастыми. Утверждения о том, что абалопаратид стимулирует образование костной ткани с меньшим сопутствующим увеличением ее резорбции чем терипаратид, имеют существенный недостаток. Существуют убедительные доказательства (Lindsay R., et al., 2006; Ma Y.L., et al., 2006), что анаболический эффект ПТГ через ПТГ/ПТГрП-рецептор у человека обеспечивается в основном (70 %) за счет увеличения количества и активности структурно-функциональных единиц костной ткани.
Недавние данные (Dempster D., et al., 2016) свидетельствуют, что существует также некоторое моделирование эффекта на поверхности надкостницы. Поэтому, если абалопаратид действует через ПТГ/ПТГрП-рецептор и при этом используется ПТГ-«анаболический» путь ремоделирования кости, резорбция является неизбежным компонентом этого процесса так как анаболический механизм ПТГ требует набора и активации новых структурно-функциональных единиц костной ткани. По логике вещей, если будет меньше ремоделирование, будет меньшим и анаболический эффект. Механизм действия абалопаратида представляет интерес, независимо от того, является ли он идентичным действию терипаратида. При трактовке эффектов абалопаратида и терипаратида необходимо принимать во внимание тот факт, что оба препарата действуют через один и тот же рецептор. (Martin T.J., Seeman E., 2017).
Молекулярные механизмы, лежащие в основе различий между абалопаратидом и терипаратидом неизвестны, но могут определяться различиями в селективности этих двух лигандов для различных конформаций ПТГ/ПТГрП-рецептора и расходящимися путями внутриклеточной сигнализации в клетках костной ткани, что может определять отличия в их совокупном ответе на эти пептидные препараты. Структурно различные лиганды могут связываться с разными конформации рецептора. Конформация рецептора R0 является G-белок-независимымой и, таким образом, не зависит от аналогов, которые действуют путем диссоциации комплекса G-белок-рецептор. Следовательно, при активации рецептора лигандом длительного действия, таким как аналог PTH (терипаратид), чистый эффект включает как анаболический так и остеорезорбтивный компоненты. И наоборот, лиганд короткого действия (абалопаратид) взаимодействует с G-белок зависимой конформацией (RG) рецептора. При этом взаимодействие рецептора с рецептором происходит лишь на короткое время из-за быстрой диссоциации комплекса лиганд-рецептор вследствие активации G-белка, тем самым вызывая чистый анаболический эффект в естественных условиях. Абалопаратид отличается от ПТГ и его аналога в 1000 раз более высокой селективной афинностью в отношении белок-зависимой (RG) конформации ПТГ/ПТГрП-рецептора (Hattersley G., et al., 2016; Cosman F., et al., 2017).
Было проведено исследование эффективности и безопасности применения абалопаратида для предотвращения новых переломов позвоночника у женщин в постменопаузе с риском развития остеопоротических переломов в сравнении с терипаратидом и плацебо. Среди женщин в постменопаузе с остеопорозом, использование подкожного введения абалопаратида в течение 18 месяцев, по сравнению с плацебо, снижало риск новых вертебральных и внепозвоночных переломов (Miller P.D., et al., 2016]. Результаты исследовани биоптатов гребня подвздошной кости с использованием количественной гистоморфометрии в подгруппах пациентов, получавщих плацебо, абалопаратид подкожно в дозе 80 мкг или терипаратид в дозе 20 мкг в течение от 12 до 18 месяцев с целью оценки безопасности влияния абалопаратида на костную ткань подтвердили, что у женщин в постменопаузе с остеопорозом получавших абалопаратид структура костной ткани, костной матрицы, морфология костных клеток и костного мозга были нормальными. Не было зафиксировано никаких признаков чрезмерного роста кости, фиброза костного мозга или нарушений минерализации (Moreira C., 2016).
Препарат прошел в 2014 году фазу III рандомизированных, двойных слепых плацебо и компаратор контролируемых клинических испытаний в рамках международного многоцентрового исследования в 28 медицинских центрах США, Великобритании, Индии, Аргентины (Miller P.D., et al., 2016,; Miller P.D., et al., 2015). В 18-месячное исследование были включены женщины в постменопаузе в возрасте 50–85 лет с T-баллом ≤ –2,5 поясничного отдела позвоночника, шейки и тела бедренной кости с предшествующим переломами позвонков или внепозвоночными переломами. Исследуемые были рандомизированы для получения абалопаратида (80 мкг подкожно ежедневно), терипаратида (ежедневно 20 мкг подкожно) или плацебо. Все испытуемые также получали препараты кальция и витамина D. Сравнительный анализ изменений МПКТ поясничного отдела позвоночника, шейки и тела бедренной кости у исследуемых всех трех групп показал, что введение женщинам абалопаратида привело к значительно большему увеличению МПКТ по сравнению с женщинами получавшими терипаратид либо плацебо через 6, 12 и 18 месяцев наблюдения во всех изученных участках скелета. В целом, у значительно большего процента пациентов зафиксировано > 3 % прироста МПКТ в группе получавших абалопаратид(54 %) по сравнению с группой женщин получавших плацебо (3,38 %,) или терипаратид (39,7 %) (Miller P., et al., 2015). По результатам 3 фазы клинических испытаний констатировано, что у женщин в постменопаузе с остеопорозом, получавших абалопаратид, наблюдалось увеличение МПКТ на всех 3 участках скелета по сравнению с пациентами, получавшими терипаратид или плацебо и сделан вывод, что абалопаратид может быть эффективным анаболическим агентом, применяемым в качестве препарата первой линии для лечения остеопороза. Меньшая по сравнению с терипаратидом стимуляция ремоделирования может предотвратить увеличение пористости и обеспечить более быстрое повышение прочности кортикальной части костной ткани. Важно определить, какой эффект вызывает введение абалопаратида после мощной антирезорбтивной терапии с использованием деносумаба или бисфосфонатов. Меньшая степень ремоделирования стимуляции в этой ситуации может удовлетворить потребности большой группы пациентов, для которых анаболический эффект является целесообразным (Cosman F., 2015).
В 2015 году на заседаниях Эндокринологического общества (Сан-Диего, Калифорния, 5–8 марта) и Американского общества минеральных исследований (Сиэтл, штат Вашингтон, 9–12 октября) были представлены предварительные результаты исследования ACTIVE в рамках которого исследовали эффекты 18-месячного введения абалопаратида на показатели МПКТ, возникновение новых переломов тел позвонков, а также внепозвоночных переломов у женщин с остеопорозом в постменопаузе в сравнении с этими же показателями у женщин получавших терипаратид (Gonnelli S., Caffarelli C., 2016). Исследование ACTIVE было рандомизированным, двойным слепым, плацебо-контролируемым, сравнительным, многоцентровым, 18-месячным международным исследованием у 2463 женщин в постменопаузе с остеопорозом, предназначенным для оценки эффективности и безопасности подкожного введения абалопаратида в дозе 80 мкг для снижения риска переломов позвонков и внепозвоночных переломов. Женщины в возрасте от 49 до 86 лет были включены в исследование ACTIVE, если у них были рентгенологические доказательства по меньшей мере 1 или 2 умеренных переломов поясничных или грудных позвонков или переломов позвоночника в анамнезе в течение предыдущих 5 лет, в дополнение к Т-баллу МПКТ ≤ –2,5 на поясничном отделе позвоночника или бедренной кости. Женщины старше 65 лет также были зарегистрированы без наличия перелома в анамнезе, если у них был Т-балл МПКТ ≤ –3,0. МПКТ измеряли на протяжении трубчатой части бедренной кости, в шейке бедра и в поясничном отделе позвоночника в начале, 6-го, 12-го и 18-го месяцев исследования. Новые костные переломы бедренной кости, в шейке бедра и в поясничном отделе позвоночника позвонков были оценены и подтверждены путем анализа медицинских и рентгенографических записей (Cosman F., et al., 2017).
Абалопаратид уменьшал возникновение новых переломов позвонков на 86 % по сравнению с плацебо (p < 0,001) и невертебральные переломы на 43 % (p = 0,049) у женщин в постменопаузе с остеопорозом. Подкожное введение абалопаратида увеличило минеральную плотность костной ткани на 3,4 % на протяжении бедренной кости, на 2,9 % в шейке бедренной кости и на 9,2 % в поясничном отделе позвоночника через 18 месяцев (все p < 0,001 против плацебо). Представленный здесь анализ был рассчитан на то, чтобы оценить, были ли сокращения риска переломов и увеличения МПКТ согласованными на разных уровнях базового риска. У исследуемых получавших абалопаратид зафиксированы наибольшее снижение частоты возникновения новых переломов позвоночника и внепозвоночных переломов по сравнению с пациентами получавших терипаратид, либо получавших плацебо. (Cosman, F., et al., 2017). В конце 18-месячного периода исследования у пациентов, получавших либо абалопаратид либо терипаратид отмечен рост МПКТ в поясничном отделе позвоночника. У пациентов, получавших абалопаратид, зафиксировано значительно большее увеличение МПКТ в бедренной кости, в дистальной части лучевой кости и в шейке бедра по сравнению с группой получавшей терипаратид (Leder B.Z., et al., 2015; Miller P.D., et al., 2015; Cosman F. et al., 2017). Не было выявлено никаких клинически значимых взаимодействий между любыми базовыми факторами риска и эффектом лечения абалопаратидом на новые морфометрические переломы позвонков, невертебральные переломы или увеличение МПКТ. Абалопаратид обеспечивает защиту от переломов последовательно в самых разных возрастных и базовых рисках, в том числе с и без предшествующих переломов, и он потенциально полезен для широкой группы женщин в постменопаузе с остеопорозом. Результаты проведенных исследований подтверждают, что абалопаратид может стать эффективным анаболическим средством для терапии остеопороза (Cosman F., 2015). Результаты ACTIVE были опубликованы в Журнале Американской медицинской ассоциации в августе 2016 года (Miller P.D., et al., 2016).
Продолжением изучения эффективности препарата в исследовании ACTIVE стало исследование ACTIVExtend с участием зарегистрированных в исследовании ACTIVE пациентов, которые после завершения 18-месячного периода подкожного введения инъекций абалопаратида или плацебо больше не получали инъекций абалопаратида или плацебо, но поддерживались в их оригинальных рандомизированнх группах лечения и получали алендронат 70 мг перорально один раз в неделю, с добавками кальция и витамина D в течение 6 месяцев (Cosman F. et al., 2017). Это исследование включало 558 пациентов, которые ранее получали абалопаратид и 581 пациентов, которые ранее получали плацебо. Совокупный 25-месячный период исследования эффективности включал 18 месяцев воздействия абалопаратида или плацебо, 1 месяц без лечения, а затем 6 месяцев терапии алендронатом. Частота новых переломов позвонков в течение 25 месяцев составила 0,6 % у пациентов, получавших абалопаратид. Относительное снижение риска новых переломов позвонков за 25 месяцев составило 87 % и невертебральных переломов 52 % у пациентов, получавших абалопаратид, а затем алендронат по сравнению с исследуемыми получавших последовательно плацебо, а затем алендронат в течение 6 месяцев Увеличение МПКТ у исследуемых получавших последовательно абалопаратид и алендронат составляло 12,8 %; 5,5 % и 4,5 % для поясничного отдела позвоночника, шейки бедра и тела бедренной кости соответственно.
Использование алендроната после подкожных инъекций абалопаратида в исследовании ACTIVExtend обеспечило официальную оценку реального терапевтического сценария для пациентов с постменопаузальным остеопорозом. Пациентам обычно показано антирезорбтивное лечение после анаболической терапии для сохранения остеоанаболических преимуществ. Данные о том, что в течение 6 месяцев лечения алендронатом в группе, которая первоначально была рандомизирована для приема абалопаратида подкожно, было значительно меньше позвоночных и невертебральных переломов, свидетельствуют о постоянном эффекте абалопаратида на улучшение прочности кости. Результаты этого исследования поддерживают раннюю анаболическую терапию в качестве потенциального варианта лечения для женщин в постменопаузе с остеопорозом поскольку большинство пациентов с предыдущими переломами или очень низкой МПКТ имеют структурные и количественные нарушения целостности скелета (Genant H.K., et al., 1996; Bell K.L., et al., 1999; Rosen C.J., et al., 2013). Кроме того, последовательность анаболической терапии, сопровождаемая антирезорбтивной терапией, может иметь наибольшую вероятность достижения увеличения МПКТ и достижения цели предотвращения переломов. По результатм исследования ACTIVExtend был сделан вывод, что последовательное применение подкожного введения абалопаратида и еженедельного перорального приема алендроната улучшает показатели МПКТ и уменьшает риск скелетных переломов и является высокоэффективным вариантом лечения для женщин в постменопаузе, подверженных риску возникновения переломов, связанных с остеопорозом. Результаты первых шести месяцев ACTIVExtend были опубликованы в начале 2017 года (Chew C.K., Clarke B.L., 2017;
Cosman F. et al., 2017). Абалопаратид был представлен на рассмотрение в Управлении по контролю за продуктами и лекарствами США (FDA) (Chew C.K., Clarke B.L., 2017) и был впервые утвержден 28 апреля 2017 года FDA под брендом «Tymlos» для лечения женщин с остеопорозом в постменопаузе, с высоким риском развития травм, имеющим в анамнезе остеопоротический перелом, множественные факторы риска перелома или для пациентов, лечение остеопороза у которых было неэффективным при использовании других доступных средств. Это первый случай за предшествующие 15 лет, когда было одобрено анаболическое средство для лечения женщин с остеопорозом.
Утвержденние FDA «Tymlos» было основано на результатах 18-месячного клинического исследования ACTIVE и первых шести месяцев исследования ACTIVExtend. Субъекты были рандомизированы для приема TYMLOS 80 мкг или плацебо, назначаемого подкожно один раз в день. Данные продемонстрировали значительное последовательное увеличение минеральной плотности костной ткании быстрое снижение риска переломов позвонков и внепозвоночных переломов вне зависимости от возраста, расы, этнической принадлежности, географического региона, длительности периода послтменопаузы, наличия или отсутствия предшествующего перелома (позвоночного или внепозвоночного) и минеральной плотности кости в начале исследования. В частности, в исследовании ACTIVE TYMLOS продемонстрировал значительное снижение относительного риска новых переломов по сравнению с плацебо: 86 % при новых переломах позвонков и 43 % при внепозвоночных переломах. Абсолютное снижение риска составило 3,6 % и 2,0 % соответственно. Компания «Radius Helth» сообщила на недавно прошедшей в США конференции в рамках «ENDO 2018» (ежегодная серия встреч эндокринологов под эгидой Американского эндокринологического общества) подробности о проведенных испытаниях абалопаратида. По сведениям представителей фармкомпании, лечение препаратом с последующим применением алендроната (подавляет костную резорбцию) привело к большему увеличению минеральной плотности костной ткани у женщин с остеопорозом по сравнению с пациентами, которые получали плацебо, а затем алендронат. В США новое лекарство от остеопороза встретили с большим энтузиазмом. Абалопаратид показал большую безопасность применения, чем использовавшийся ранее терипаратид (он в два раза чаше вызывает гиперкальциемию).
По мнению Джона Билезикяна профессора медицины и фармакологии Колледжа врачей и хирургов Колумбийского университета, почетного шефа отделения эндокринологии и директора программы по метаболическим заболеваниям костей в медицинском центре Колумбийского университета «Одобрение TYMLOS FDA предоставляет врачам новый вариант лечения для женщин в постменопаузе с остеопорозом, который может помочь быстро, последовательно и значительно увеличить плотность минеральных веществ в костях и снизить риск переломов. Утверждение FDA TYMLOS представляет собой важный шаг в нашей способности лечить это серьезное и сложное заболевание». Заявка на разрешение использования подкожного введения абалопаратида для лечения женщин в постменопаузе с остеопорозом была принята Европейским агентством по лекарственным средствам и в настоящее время рассматривается.
Абалопаратид производится «Radius Health Inc.» (Nasdaq: RDUS), биомедицинской компанией, базирующейся в Уолтхеме, штат Массачусетс. Эта компания сосредоточена на разработке новых терапевтических средств для лечения остеопороза, рака и эндокринных заболеваний. В июле 2017 года Radius Health лицензировала права Teijin Limited для производства и коммерциализации абалопаратида для подкожного введения в Японии. Teijin Limited по соглашению с Ipsen Pharma SAS проводит клиническое исследование фазы III у японских пациентов с остеопорозом. «Radius Health Inc.» в продолжение линии абалопаратида для подкожного введения (Abaloparatide SC) разрабатывает также трансдермальную композицию абалопаратида (Abaloparatide-TD) в виде удобного, трансдермального пластыря (Abaloparatide-TD) (Saeh J., et al., 2016). В недавно проведенной рандомизированной, двойной слепой, плацебо-контролируемой фазе 2 клинических испытаний в девяти центрах в Соединенных Штатах, Дании, Польши и Эстонии исследовали клиническую эффективность и безопасность Abaloparatide-TD. Оценивали изменения МПКТ по сравнению с трансдермальным плацебо и Abaloparatide-SC. У женщин в возрасте от 55 до 85 (включительно) у которых была МПКТ-баллов ≤ –2,5 в поясничном отделе позвоночника или бедра (шейки бедра). Abaloparatide-TD вводили с помощью подпружиненного аппликатора, а Abaloparatide-SC вводили с помощью многофункционального пера инжектора, в который был вставлен стеклянный картридж с мультидозой. За четыре недели до начала лечения, пациенты начали принимать препараты кальция и витамина D, которые продолжались на протяжении всего исследования. Исследуемый препарат вводился один раз в день в течение в общей сложности шести месяцев. Abaloparatide-TD продемонстрировал статистически значимое увеличение среднего процента МПКТ по сравнению с плацебо в поясничном отделе позвоночника и в тазобедренном суставе. Эти результаты показали четкое доказательство достижения зависимого от дозы увеличения МПКТ. После дополнительной работы разработчики намерены продвигать оптимизированный Abaloparatide-TD в дополнительных клинических исследованиях 3 фазы и затем представить его на утверждение.
Утверждается, что дальнейшее исследование других аналогов ПТГрП является перспективным и целесообразным, поскольку у них есть потенциал, чтобы выступать в качестве альтернативных анаболических скелетных факторов, которые могли бы быть полезными для решения некоторых проблем современной медицины (Augustine M., Horwitz M.J., 2013; Martin T.J., 2016).
В заключение анализа данных литературы по вопросу остеотропных и хондрогенных эффектов ПТГрП представляется возможным констатировать, что ПТГрП является исключительно важным белком не только для нормальных физиологических процессов, таких как пренатальное развитие скелета, участие в метаболизме кальция и регуляция костного ремоделирования в постнатальном периоде, но и в качестве чрезвычайно значимого фактора развития различных видов рака и их костного метастазирования. ПТГрП является ключевым регулятором взаимодействия опухолевых клеток и костной микросреды оказывая многогранное действие посредством эндокринных, паракринных, аутокринных и интракринных механизмов на различные биологические функции.
Проведенный анализ большого массива научной литературы позволил констатировать, что в настоящее время ПТГрП рассматривается как один из ключевых регуляторов морфофункциональных, патобиохимических и патологических процессов в костной и хрящевой ткани человека и других биологических видов. В настоящее время, исследования в области фундаментальной биологи, патофизиологи и патобиохимии ПТГрП дали огромный и чрезвычайно многоплановый материал о роли этого мультипотентного протеина в развитии различных болезненных состояний и обозначили перспективы использования его биологически активных доменов в терапии патологических изменений хрящевых и костных структур и в том числе остеопороза, а также в других практических разработках в области медицины, базирующихся на использовании остеотропных эффектов ПТГрП.