
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
Производство стирола и образование кубовых остатков его ректификации
Для получения стирола известен целый ряд способов, многие из них находят промышленное применение. Из потенциально применяемых методов представляет интерес процесс получения стирола из толуола и этилена [11], способ совместного получения стирола, этилбензола и бензола [12], прямым воздействием бензола с этиленом [13], путем дегидродимеризации толуола до стильбена с последующим метатезисом стильбена с этиленом [14], каталитической дегидратацией α-метилбензилового спирта [15]. Значительную долю стирола в промышленности получают экстракцией стирола из фракции С8 пироконденсата [16], способ совместного производства стирола и α-метилстирола [17], по методу фирмы «Халкон» одновременно с оксидом пропилена [18], окислительным дегидрированием этилбензола [19-21].
Однако, несмотря на многообразие известных способов, основным методом получения стирола в промышленных масштабах остается каталитическое дегидрирование этилбензола при высоких температурах.
Разработан способ получения стирола каталитическим дегидрированием этилбензола в присутствии водяного пара с последующей ректификацией углеводородного конденсата, который предварительно перед стадией ректификации подвергают каталитическому гидрированию на палладийсодержащих катализаторах при температуре 20-30 оС, объемной скорости 4,5-5,0 ч-1 и объемном соотношении водород-сырье, равном 35-45, для выделения стирола-ректификата, возвратного этилбензола, бензолтолуольной фракции и кубового остатка ректификации стирола углеводородный конденсат [22].
Наибольшую сложность в технологическом процессе выделения стирола представляет стадия его очистки от этилбензола и побочных продуктов, образующихся при дегидрировании [23, 24].
В России, как и в ряде зарубежных стран реализована технология совместного производства стирола и оксидов олефинов [18, 25]. В нашей стране этот вариант стирольного производства был разработан ВНИИОлефином (г. Баку, Азербайджан) совместно с ВНИИНефтехимом (г. Москва), и запроектирован ОАО «Синтезкаучукпроект» (г. Воронеж). С 1982 года на ОАО «Нижнекамскнефтехим» введено в эксплуатацию совместное производство стирола и оксида пропилена мощностью 138 тыс. и 50 тыс. т/год соответственно.
Технология совместного получения стирола и оксида пропилена состоит из следующих стадий:
- получение гидропероксида этилбензола (ГПЭБ) окисление этилбензола
С6Н5-СН2-СН3 + О2 → С6Н5-СН(ООН)-СН3,
- выделение гидропероксида этилбензола;
- эпоксидирование полученным гидропероксидом олефина (пропилена) и разделение продуктов эпоксидирования
С6Н5-СН(ООН)-СН3 + СnН2n → С6Н5-СН(ОН)-СН3 + СnН2nО,
- дегидратация образовавшегося метилфенилкарбинола (МФК) и выделение стирола
С6Н5-СН(ОН)-СН3 → С6Н5-СН=СН2 + Н2О,
- гидрирование ацетофенона с образованием метилфенилкарбинола
С6Н5-СО-СН3 + Н2 → С6Н5-СН(ОН)-СН3.
Таким образом, это производство является многостадийным. Оно наиболее перспективно, потому что наряду со стиролом позволяет получать важные эпоксидные соединения, например, оксид пропилена. Стирол и оксид пропилена имеют большое значение в отрасли основного органического и нефтехимического синтеза. Если первый является важнейшим мономером для производства широкого круга каучуков и полимеров, то второй используется не только для производства каучуков (пропиленоксидных каучуков), но и важных продуктов и полупродуктов основного органического и нефтехимического синтеза (пропиленгликолей, неионогенных поверхностно-активных веществ - проксанолов и проксаминов, аллилового спирта, пропиленкарбоната, изопропаноламинов).
Конечно же, целесообразно совместное получение нескольких целевых продуктов, чем их получение с помощью самостоятельных процессов. Кроме того, такой способ получения продуктов не только экономически, но и экологически более чистый, так как в нем образуется меньше побочных продуктов, на выделение которых тратится энергия и сырье.
Поскольку дегидратация метилфенилкарбинола происходит при относительно невысоких температурах (~300 оС), то стирол получается с минимальным количеством примесей. Ещё одним преимуществом этого метода является более простая схема ректификации стирола.
В процессах получения стирола различными промышленными способами (дегидрированием этилбензола или через стадию дегидратации метилфенилкарбинола), образование побочных продуктов термодинамически вероятно на всех стадиях процесса. Однако наибольшую скорость образования побочных продуктов следует ожидать в реакторе дегидрирования, промежуточном межреакторном теплообменнике, на первой ступени конденсации контактного газа и в кипятильниках ректификационных колонн.
При высоких температурах в реакторе возможно протекание следующих реакций:
- дегидрирование с образованием стирола, фенилацетилена, дивинилбензола и водорода
С6Н5С2Н5 → С6Н5С2Н3 + Н2,
С6Н5С2Н3 → С6Н5С2Н + Н2,
С6Н4(С2Н5)2 → С6Н4(С2Н3)2 + 2Н2,
- деалкилирование
С6Н5С2Н5 → С6Н6 + С2Н4 - бензол, этилен,
С6Н5С2Н5 → С7Н8 + СН4 - толуол, метан,
С6Н5С2Н5 → С6Н6 + С2Н4 - бензол, этилен,
- диспропорционирование
nС6Н5С2Н5 → (n-k)С6Н5С2Н5 + С6Н5-k(С2Н5)k+1 - диэтилбензол, ксилолы и т. п.
С6Н5С2Н5 + С6Н5С2Н5 → С6Н5С(СН3)СН2 + С6Н5СН3 + Н2 - α-метил-стирол, толуол, водород,
- конденсация
2С6Н6 → С6Н5-С6Н5 + Н2 - дифенил, водород,
2С7Н8 → С6Н5-СН2-СН2-С6Н5 + Н2 - дибензил, водород.
При дегидрировании дибензила возможно образование стильбена
С6Н5-СН2-СН2-С6Н5 → С6Н5-СН=СН-С6Н5 + Н2.
Путем конденсации образуются антрацен, фенантрен, нафталин, стильбен, алкилинданы и другие соединения [26].
При конденсации в продуктах процесса дегидрирования этилбензола в стирол возможно попадание воздуха, что может привести к образованию продуктов окисления стирола и этилбензола, а в процессе совместного получения стирола и оксида пропилена идет образование кислородсодержащих соединений: ацетофенона, бензойной кислоты, бензальдегида и др.
С6Н5-С2Н5 + О2 → С6Н5-СО-СН3 + Н2О,
С6Н5-С2Н5 + 2,5О2 → С6Н5-СООН + СО2 + 2Н2О,
С6Н5-С2Н5 + 2О2 → С6Н5-СНО + СО2 + 2Н2О.
В основе технологии получения гидропероксида этилбензола лежит реакция жидкофазного окисления этилбензола молекулярным кислородом. В результате окисления этилбензола наряду с гидропероксидом (на него расходуется более 98 % этилбензола) образуются метилфенилкарбинол и ацетофенон. Кроме того, в продуктах окисления обнаружены бензальдегид, бензойная и муравьиная кислоты, пероксид водорода, 2,3-дифенилбутан.
В настоящее время установлено, что реакция получения гидропероксида этилбензола протекает по схеме, учитывающей параллельно-последовательный механизм образования ацетофенона и возможность рекомбинации радикалов RO2 непосредственно в МФК и ацетофенон (а не через стадию образования гидропероксида). Следовательно, схему окисления этилбензола можно представить следующим образом:
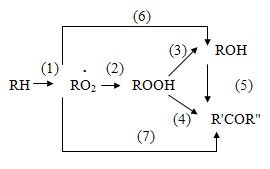
Результаты кинетических исследований реакции окисления этилбензола показывают, что скорости образования метилфенилкарбинола и ацетофенона по реакциям (3), (6) и (4), (7) равны между собой. Это свидетельствует о том, что скорости образования кетона и спирта через пероксидные радикалы одинаковы. Однако при накоплении в системе определенного количества метилфенилкарбинола скорость реакции (5) превышает суммарную скорость реакций (4) и (7), а метилфенилкарбинол становится основным источником образования ацетофенона [25, 27].
Кроме того, в процессе совместного получения стирола и оксида пропилена, возможно, протекание следующих последовательно-параллельных реакций:
- получение ацетофенона
C6H5-CH2-CH3 + O2 → C6H5-CO-CH3 + H2O,
- стадия эпоксидирования, на которой ГПЭБ и пропилен, реагируют с образованием оксида пропилена, образовавшийся при этом МФК является сопутствующим продуктом
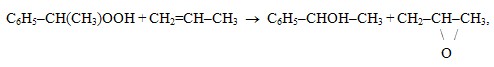
- реакция ГПЭБ и пропилена с образованием МФК и ацетона
C6H5-CH(CH3)OOH + CH2=CH-CH3 → C6H5-CHOH-CH3 + CH3-CO-CH3,
- ГПЭБ и пропилен реагируют с образованием изопропилового спирта и ацетофенона
C6H5-CH(CH3)OOH + CH2=CH-CH3 → C6H5-CHOH-CH3 + C6H5-CO-CH3,
- ГПЭБ разлагается с образованием фенола и ацетальдегида
C6H5-CH(CH3)OOH → C6H5-OH + CH3-CHO,
- ГПЭБ разлагается с образованием ацетофенона и воды
C6H5-CH(CH3)OOH → C6H5-CO-CH3 + H2O,
- дегидратация метилфенилкарбинола в стирол
C6H5-CH(OH)-CH3 → C6H5-CH=CH2 + H2O,
- метилфенилкарбинол дегидрируется в ацетофенон и водород
C6H5-CH(OH)-CH3 → C6H5-CO-CH3 + H2,
- гидрирование ацетофенона до этилбензола и воды
C6H5-CO-CH3 + 2H2 → C6H5-CH2-CH3 + H2O.
Реакции последовательного разложения гидропероксида в условиях окисления вносят довольно заметный вклад в образование побочных продуктов. Чтобы избежать последовательных превращений гидропероксида, ограничивают конверсию этилбензола (до 10 %). Кроме того, для повышения селективности образования гидропероксида этилбензола реакторная система должна быть максимально приближена по гидродинамическому режиму к системе идеального вытеснения (по жидкой фазе). На практике окисление осуществляют в каскаде последовательных реакторов-колонн (обычно больше трех). Для получения алкилароматических гидропероксидов также используют реакторы типа тарельчатой колонны с встроенными змеевиками на каждой тарелке или пустотелой колонны также с встроенными змеевиками.
В кубах ректификационных колонн концентрация стирола повышается до 80-90 % и, хотя присутствие ингибиторов сильно замедляет протекание побочной реакции полимеризации стирола, следует, однако, отметить, что полностью исключить этот процесс не представляется возможным. Поэтому потери стирола будут вследствие его высокотемпературной полимеризации, инициированной полимеризации и сополимеризации.
Высокотемпературная полимеризация - первичный процесс, приводящий к образованию полимера линейного строения. Эта реакция сильно замедляется ингибиторами.
Инициированная полимеризация возникает при попадании пероксидных соединений в жидкость (печное масло), образующуюся после конденсации парообразных углеводородов, отделенных от газов (метана, этилена, водорода и диоксида углерода).
Сополимеризация протекает при наличии в печном масле дивинилбензола, фенилацетилена и других мономеров, что приводит к образованию полимеров разветвленного или сетчатого строения.
Кроме того, при ректификации возможны реакции каталитической пластификации полимера тяжелыми углеводородами, образовавшимися в процессе дегидрирования, особенно при длительном времени пребывания в колоннах. Так, например, нафталин и фенантрен способны реагировать с полимером стирола, разрывая длинные цепи по реакции
R1-R2 + С10Н8 → R1H + С10Н7-R2.
Подобные вторичные реакции уменьшают среднюю молекулярную массу полимера, повышают его полидисперсность.
Доказано, что высокотемпературная полимеризация стирола протекает по радикальному механизму [28-31]. Причем, инициирование радикальной полимеризации, то есть создание в реакционной среде свободных радикалов, способных начать реакционные цепи, становится возможным при нагревании самого мономера [30, 31]
RH → R• + H•.
Так и за счет разложения не стойких пероксидных соединений, образующихся при контакте стирола с воздухом уже при комнатной температуре [28, 30, 32]
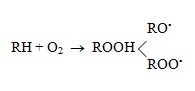
Для подавления самопроизвольной полимеризации стирола на стадии его выделения из продуктов дегидрирования применяют различные ингибиторы. Способность йода, серы и других веществ замедлять или вообще препятствовать протеканию полимеризации стирола известна давно [33, 34]. Для подавления самопроизвольной полимеризации стирола предлагается широкий класс соединений: моно- и диалкилкатехины, N-алкил-N-арилгидроксиламин, N-циклогексилгидроксиламин, диалкилоксиаминовые соли, монооксим п-хинона, семикарбазиды и их производные, печная сажа в сочетании с органическими пероксидами, N,N-ди-(низший алкид)-гидроксиламиновые соли алифатических карбоновых кислот, трет-аминонафтолы, медные соли ди-2(2-этилгексил)-дитиофосфорной кислоты, диоксим п-хинона, инертные газы [35], ацетаты гидроксиламмония [36], органические эфиры фосфорной кислоты [37], смесь диоксим п-хинона с гидрохиноном [38], бис-(о-изопропилтиокарбонил-гидразон)-N-нафтохинона (БИКН) [39], N,N,N',N'-тетра-(3,5-ди-трет-бутил-4-окси-бензил)-этилендиамин [40].
В промышленности применение получили только гидрохинон, монооксим-п-хинона, п-нитрофенол, смесь диоксим-п-хинона с гидрохиноном [38], сера и смесь серы с трет-бутилпирокатехином [41]. Однако использование указанных ингибиторов не исключает при выделении стирола из печного масла ректификацией образования полимера, накапливающегося в КОРС наряду с ингибиторами и многими другими органическими веществами, из которых идентифицировано от 25 до 40 соединений [42]. Взаимодействие ингибиторов с мономерным стиролом приводит к образованию побочных веществ, также накапливающихся в кубовых остатках.
Кубовые остатки ректификации стирола получаются двумя путями. При одноступенчатом дегидрировании в старых производствах кубовый остаток ректификационных колонн направляется в отгонные кубы, где из него отгоняется стирол. Процесс периодический, проводится под вакуумом до возможно более полного выделения стирола, в результате получается КОРС с содержанием стирола до 35 мас.%. При двухступенчатом дегидрировании кубовые остатки, образовавшиеся в процессе выделения стирола, направляют в роторно-пленочные испарительные аппараты непрерывного действия. Отгонка также производится под вакуумом до содержания мономерного стирола в КОРС до 25 мас.%.
Количество отходов колеблется в зависимости от срока службы катализатора, состава сырья и применяемых ингибиторов от 20 до 30 кг на одну тонну стирола [26].
