
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.1.1. рН растворов слабых кислот и оснований
В водном растворе слабой кислоты устанавливается равновесие:
HF + H2O D F– + H3O+,
в котором участвуют две кислотно-основные пары: HF/F– и H3O+/H2O. Сила кислоты HF количественно характеризуется ее константой кислотности КА:
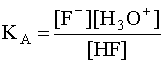 .
.
Чем больше численное значение константы кислотности, тем сильнее данная кислота и слабее сопряженное с ней основание. В общем случае константа кислотности может быть записана следующим образом:
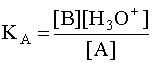 (4)
(4)
где [A] и [B] - равновесные концентрации кислоты и сопряженного с ней основания.
Наиболее важной химической характеристикой водного раствора является его водородный показатель pH = - lg [H3O+].
Если в водном растворе присутствует только рассматриваемая кислота A и ее сопряженное основание B, то, учитывая, что в состоянии равновесия [B]=[H3O+], а также приняв, что равновесная концентрация [A] в первом приближении равна исходной концентрации этой кислоты, то есть [A] » CA, имеем
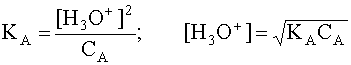 .
.
Прологарифмируем это равенство и произведем алгебраические преобразования:
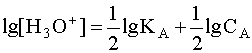 .
.
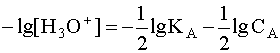 .
.
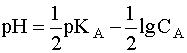 (5)
(5)
Когда имеем раствор основания B, то в нем устанавливается равновесие:
B + H2O D A + OH––,
характеризующееся константой основности
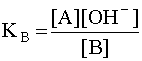 (6)
(6)
Чем больше численное значение константы основности, тем это основание сильнее и тем слабее сопряженная с ним кислота. В справочной литературе обычно приводятся только константы кислотности, но поскольку для любой сопряженной кислотно-основной пары произведение константы кислотности на константу основности есть величина постоянная, равная ионному произведению воды
![]() ,
,
то соотношение (6) можно записать следующим образом:
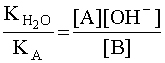 .
.
С учетом того, что [A] = [OH–], а [B] » CB, имеем:
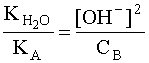 .
.
откуда
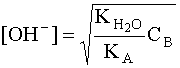 .
.
Прологарифмировав это выражение и произведя соответствующие преобразования, получим:
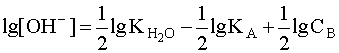 .
.
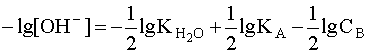 .
.
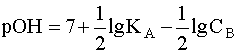 .
.
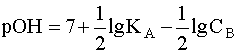 .
.
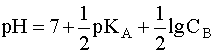 (7)
(7)
Для расчета рН раствора слабой кислоты или слабого основания можно вывести и другое выражение, в которое не входит исходная концентрация С растворенного вещества. Для этого следует прологарифмировать выражение (4) и выразить рН раствора следующим образом:
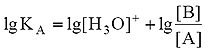 .
.
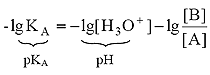 .
.
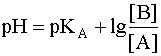 (8)
(8)
Данное уравнение выведено, исходя из выражения константы кислотности (1), однако оно пригодно и для вычисления рН раствора основания В, сопряженного с кислотой А, в чем Вы можете убедиться, выведя его из выражения константы основности (6). В дальнейшем будем пользоваться только константами кислотности (К) и их показателями (рК).
